Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER (-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
z zakażeniem wirusowym, grzybiczym lub pasożytniczym, które nie są kontrolowane za pomocą odpowiedniego leczenia
cukrzycą
hiperadrenokortycyzmem
osteoporozą
niewydolnością serca
niewydolnością nerek
owrzodzeniem rogówki
wrzodami przewodu pokarmowego
jaskrą
Nie stosować jednocześnie z atenuowanymi żywymi szczepionkami
Nie stosować w przypadkach nadwrażliwości na substancję czynną, na inne kortykosteroidy lub na dowolną substancję pomocniczą.
Patrz również punkt 4.7. i 4.8.
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Prednizolon lub inne kortykosteroidy mogą powodować nadwrażliwość (reakcje uczuleniowe).
Osoby o znanej nadwrażliwości na prednizolon lub inne kortykosteroidy lub na którąkolwiek substancję pomocniczą produktu powinny unikać kontaktu z produktem leczniczym weterynaryjnym.
W celu uniknięcia przypadkowego połknięcia, zwłaszcza przez dziecko, niezużyte części tabletki należy włożyć z powrotem do otwartego blistra, a następnie do pudełka.
Po przypadkowym połknięciu, szczególnie przez dziecko, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub etykietę.
Kortykosteroidy mogą powodować wady rozwojowe płodu. W związku z tym zaleca się, by kobiety w ciąży unikały kontaktu z produktem leczniczym weterynaryjnym.
Natychmiast po podaniu tabletek należy dokładnie umyć ręce.
Działania niepożądane (częstość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
hamowaniem fosfolipazy A2, która zmniejsza syntezę kwasu arachidonowego, prekursora wielu metabolitów prozapalnych. Kwas arachidonowy jest uwalniany z komponenty fosfolipidowej błony komórkowej w wyniku działania fosfolipazy A2. Kortykosteroidy pośrednio hamują ten enzym, indukując endogenną syntezę polipeptydów, lipokortyn, działających hamująco na fosfolipazę;
działaniem stabilizującym na błonę, w szczególności w odniesieniu do lizosomów, co zapobiega uwalnianiu enzymów na zewnątrz przedziału lizosomalnego.
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER (-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Hedylon 25 mg, tabletki dla psów
Każda tabletka zawiera:
Substancja czynna:
Prednizolon 25 mg
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Tabletka.
Białe okrągłe tabletki z linią podziału w kształcie krzyżyka po jednej stronie i wytłoczoną liczbą 25 po drugiej stronie.
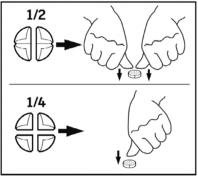
Tabletki można podzielić na 2 lub 4 równe części.
Psy
Leczenie objawowe lub jako leczenie wspomagające stanu zapalnego i chorób o podłożu immunologicznym u psów.
Nie stosować u zwierząt z:
Podawanie kortykosteroidów ma na celu spowodowanie poprawy w zakresie objawów klinicznych, a nie wyleczenie. Leczenie powinno być skojarzone z leczeniem choroby podstawowej i (lub) kontrolą środowiska.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
W przypadkach obecności infekcji bakteryjnej, produkt należy stosować w skojarzeniu z odpowiednim leczeniem antybakteryjnym. Farmakologicznie czynne poziomy dawek mogą powodować niewydolność kory nadnerczy. Tego typu niewydolność może się ujawnić zwłaszcza po zakończeniu leczenia kortykosteroidem. Niewydolność kory nadnerczy można zminimalizować, wprowadzając leczenie co drugi dzień, jeśli jest to możliwe. Dawkę należy zmniejszać i wycofywać stopniowo, aby uniknąć wystąpienia niewydolności kory nadnerczy (patrz punkt 4.9).
Kortykosteroidy, takie jak prednizolon, nasilają katabolizm białek. W związku z tym produkt należy stosować ostrożnie u starych lub niedożywionych zwierząt.
Kortykosteroidy, takie jak prednizolon, należy stosować ostrożnie u pacjentów z nadciśnieniem, padaczką, oparzeniami, uprzednio występującą miopatią steroidową, u zwierząt o obniżonej odporności i u młodych zwierząt, ponieważ kortykosteroidy mogą powodować opóźnienie wzrostu.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Wiadomo, że kortykosteroidy o działaniu przeciwzapalnym, takie jak prednizolon, wywołują wiele działań niepożądanych. Pojedyncze, duże dawki są na ogół dobrze tolerowane, jednak długotrwałe stosowanie może wywołać ciężkie działania niepożądane.
Odnotowana w trakcie leczenia, zależna od dawki, znaczna supresja wydzielania kortyzolu jest wynikiem zahamowania osi podwzgórze-przysadka-nadnercza po podaniu dawki skutecznej. Po zaprzestaniu leczenia, mogą wystąpić oznaki niewydolności kory nadnerczy, co może spowodować, że zwierzę nie będzie w stanie właściwie reagować w sytuacjach stresowych.
Odnotowany znaczny wzrost stężenia trójglicerydów może być objawem możliwego jatrogennego hyperadrenokortycyzmu (zespół Cushinga) powodującego istotne zmiany w metabolizmie tłuszczów, węglowodanów, białek i minerałów, które mogą prowadzić na przykład do redystrybucji tłuszczów w organizmie, przyrostu masy ciała, osłabienia i zaniku mięśni oraz osteoporozy. Supresja wydzielania kortyzolu i zwiększenie stężenia trójglicerydów w osoczu jest bardzo często występującym działaniem niepożądanym leków zawierających kortykosteroidy (więcej niż 1 na 10 zwierząt).
Obserwowano zmiany w parametrach biochemicznych, hematologicznych i wątrobowych prawdopodobnie związane ze stosowaniem prednizolonu, obejmujące znaczny wpływ na fosfatazę alkaliczną (wzrost), dehydrogenazę mleczanową (obniżenie), albuminy (wzrost), eozynofile, limfocyty (spadek), neutrofile segmentowe (wzrost) oraz enzymy wątrobowe w surowicy (wzrost).
Obserwowano również zmniejszenie aktywności aminotransferazy asparaginianowej.
Kortykosteroidy podawane układowo mogą powodować poliurię, polidypsję i polifagię, szczególnie w początkowym okresie leczenia. Niektóre kortykosteroidy podczas długotrwałego stosowania mogą powodować zatrzymywanie sodu i wody w organizmie oraz hipokaliemię. Ogólnoustrojowo podawane kortykosteroidy powodowały odkładanie się wapnia w skórze (wapnica skóry).
Stosowanie kortykosteroidów może opóźniać gojenie się ran, a ich działanie immunosupresyjne może osłabiać odporność lub nasilać istniejące infekcje.
U zwierząt leczonych kortykosteroidami zgłaszano owrzodzenie układu pokarmowego. Steroidy mogą powodować zaostrzenie owrzodzenia układu pokarmowego u zwierząt, którym podaje się niesteroidowe leki przeciwzapalne i u zwierząt z urazem rdzenia kręgowego.
Inne działania niepożądane, które mogą wystąpić obejmują: zahamowanie wzrostu kości na długość, zanik skóry, cukrzycę, zaburzenia zachowania (ekscytacja i depresja), zapalenie trzustki, spadek syntezy hormonu tarczycy, zwiększenie syntezy hormonu przytarczyc. Patrz także punkt 4.7
Częstość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Nie stosować u zwierząt w okresie ciąży. Badania laboratoryjne wykazały, że podawanie na początku ciąży może powodować nieprawidłowości u płodu. Stosowanie w późniejszych okresach ciąży może powodować poronienie lub przedwczesny poród.
Glikokortykosteroidy przechodzą do mleka matki i mogą powodować zaburzenia wzrostu u ssących młodych zwierząt. W związku z tym produkt powinien być stosowany u suk w okresie laktacji jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Fenytoina, barbiturany, efedryna i ryfampicyna mogą przyspieszać klirens metaboliczny kortykosteroidów, zmniejszając ich stężenie we krwi i osłabiając ich działanie fizjologiczne. Jednoczesne podawanie tego produktu leczniczego weterynaryjnego z niesteroidowymi lekami przeciwzapalnymi może zaostrzać owrzodzenie przewodu pokarmowego.
Podanie prednizolonu może wywołać hipokaliemię i w związku z tym zwiększać ryzyko wystąpienia toksyczności po podaniu glikozydów nasercowych. Ryzyko hipokaliemii może wzrosnąć w przypadku jednoczesnego stosowania prednizolonu z diuretykami obniżającymi poziom potasu.
Należy zachować ostrożność w przypadku jednoczesnego stosowania z insuliną.
Leczenie produktem leczniczym weterynaryjnym może zmieniać skuteczność szczepienia. W przypadku szczepienia atenuowanymi żywymi szczepionkami należy zachować dwutygodniowy odstęp przed lub po leczeniu.
Podanie doustne.
Dawkę i całkowity okres leczenia, w dopuszczalnym zakresie dawkowania, ustala lekarz weterynarii indywidualnie dla każdego przypadku w zależności od nasilenia objawów.
Dawka początkowa: 0,5 - 2,0 mg na kg masy ciała na dobę.
Przy powyższych poziomach dawkowania może być wymagane podawanie przez okres od jednego do trzech tygodni. W przypadku długotrwałego leczenia: w momencie, gdy po okresie codziennego podawania dawki uzyskano pożądany efekt, dawkę należy zmniejszać do czasu uzyskania najniższej skutecznej dawki. Zmniejszanie dawki powinno się odbywać z zastosowaniem schematu leczenia co drugi dzień i (lub) zmniejszeniem dawki o połowę co 5-7 dni do momentu uzyskania najniższej skutecznej dawki.
Leczenie u psów należy stosować rano, aby dostosować je do szczytowego endogennego stężenia kortyzolu.
Poniższa tabela zawiera wskazówki dotyczące podawania produktu w minimalnej dawce 0,5 mg/kg
m.c. i maksymalnej dawce 2 mg/kg m.c.:
Liczba tabletek | ||
Hedylon 25 mg dla psów | ||
Masa ciała (kg) | Minimalna dawka 0,5 mg/kg m.c. | Maksymalna dawka 2 mg/kg m.c. |
> 10 - 12,5 kg | ¼ | 1 |
>12,5 - 25 kg | ½ | 1-2 |
>25 - 37,5 kg | ¾ | 2-3 |
> 37,5 - 50 kg | 1 | 3-4 |
> 50 - 62,5 kg | 1 ¼ | 4-5 |
> 62,5 - 75 kg | 1 ½ | 5-6 |
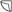
= ¼ tabletki 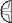 = ½ tabletki
= ½ tabletki  = ¾ tabletki
= ¾ tabletki  = 1 tabletka
= 1 tabletka
Tabletki można dzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania.
Przedawkowanie nie powoduje innych działań niepożądanych niż wymienione w punkcie 4.6. Brak swoistego antidotum. Objawy przedawkowania należy leczyć objawowo.
Nie dotyczy.
Grupa farmakoterapeutyczna: kortykosteroid do stosowania ogólnoustrojowego, glikokortykosteroidy, prednizolon.
Kod ATCvet: QH02AB06.
Prednizolon jest syntetycznym kortykosteroidowym, lekiem przeciwzapalnym należącym do rodziny glikokortykoidów. Główne efekty działania prednizolonu są takie same, jak w przypadku glikokortykoidów:
Działanie przeciwzapalne:
Po podaniu prednizolonu w małych dawkach, dochodzi do ekspresji jego właściwości przeciwzapalnych, co tłumaczy się:
Działanie immunosupresyjne:
Po podaniu większej dawki immunosupresyjne właściwości prednizolonu są wywierane zarówno na makrofagi (wolniejsza fagocytoza, zmniejszony przepływ do ognisk zapalnych), jak i na neutrofile i limfocyty. Podawanie prednizolonu zmniejsza wytwarzanie przeciwciał i hamuje kilka składników dopełniacza.
Działanie przeciwuczuleniowe:
Podobnie jak wszystkie kortykosteroidy, prednizolon hamuje uwalnianie histaminy przez komórki tuczne. Prednizolon wykazuje aktywność wobec wszystkich objawów uczulenia jako uzupełnienie swoistego leczenia.
Po podaniu doustnym prednizolon jest szybko wchłaniany z przewodu pokarmowego. Maksymalne stężenie w osoczu występuje od 0,5 do 1,5 godziny po podaniu, a okres półtrwania w osoczu wynosi od 3 do 5 godzin. Podlega dystrybucji do wszystkich tkanek i płynów ustrojowych, a nawet do płynu mózgowo-rdzeniowego. Prednizolon w znacznym stopniu wiąże się z białkami osocza, jest metabolizowany w wątrobie oraz wydalany głównie za pośrednictwem nerek. Jest wydalany z moczem w postaci wolnych i skoniugowanych metabolitów oraz związku macierzystego. Okres biologicznego półtrwania wynosi kilka godzin, dzięki czemu nadaje się do terapii co drugi dzień.
Laktoza jednowodna Skrobia kukurydziana Skrobia preżelowana
Krzemionka koloidalna bezwodna Talk
Magnezu stearynian
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 3 lata. Każdą niewykorzystaną część tabletki należy ponownie umieścić w blistrze i zużyć w ciągu 4 dni.
6,4. Specjalne środki ostrożności podczas przechowywania
Przechowywać w temperaturze poniżej 25°C.
Przechowywać blister w opakowaniu zewnętrznym w celu ochrony przed światłem.
Blister z nieprzezroczystego PVC/aluminium Wielkości opakowań:
Pudełko zawierające 1, 3, 5, 10 lub 25 blistrów po 10 tabletek. Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
LIVISTO Int’l, S.L.
Av. Universitat Autònoma, 29
08290 Cerdanyola del Vallès (Barcelona) Hiszpania
2876/19
/ DATA PRZEDŁUŻENIA POZWOLENIA
16/05/2019
06/05/2022











