Spis treści:
- Nazwa weterynaryjnego produktu leczniczego
- Skład
- Docelowe gatunki zwierząt
- Wskazania lecznicze
- Przeciwwskazania
- Specjalne ostrzeżenia
- Zdarzenia niepożądane
- Dawkowanie dla każdego gatunku, drogi i sposób podania
- Zalecenia dla prawidłowego podania
- Okresy karencji
- Specjalne środki ostrożności podczas przechowywania
- Specjalne środki ostrożności dotyczące usuwania
- Klasyfikacja weterynaryjnych produktów leczniczych
- Numery pozwolenia na dopuszczenie do obrotu i wielkości opakowań
- Data ostatniej aktualizacji ulotki informacyjnej
- Dane kontaktowe
ULOTKA INFORMACYJNA
Nazwa weterynaryjnego produktu leczniczego
Skład
Docelowe gatunki zwierząt
Wskazania lecznicze
Przeciwwskazania
Specjalne ostrzeżenia
Zdarzenia niepożądane
Dawkowanie dla każdego gatunku, drogi i sposób podania
Zalecenia dla prawidłowego podania
Okresy karencji
Specjalne środki ostrożności podczas przechowywania
Specjalne środki ostrożności dotyczące usuwania
Klasyfikacja weterynaryjnych produktów leczniczych
Numery pozwolenia na dopuszczenie do obrotu i wielkości opakowań
Data ostatniej aktualizacji ulotki informacyjnej
Dane kontaktowe
Inne informacje
Prasequin vet. 1 mg tabletki dla koni
Każda tabletka zawiera:
Substancja czynna:
Pergolid 1,0 mg
(co odpowiada 1,31 mg pergolidu mezylanu)
Substancja pomocnicza:
Skład jakościowy substancji pomocniczych i pozostałych składników |
Laktoza jednowodna |
Kroskarmeloza sodowa |
Powidon |
Magnezu stearynian |
Żelaza tlenek żółty (E172) |
Tabletka;
Prawie biała, okrągła i wypukła tabletka z linią podziału w kształcie krzyża po jednej stronie; tabletki można podzielić na 2 lub 4 równe części.
Konie (nieprzeznaczone do spożycia przez ludzi)
Leczenie objawowe symptomów klinicznych związanych z dysfunkcją części pośredniej przysadki
mózgowej (ang. Pituitary Pars Intermedia Dysfunction, PPID; zespół Cushinga koni).
Nie stosować u koni ze znaną nadwrażliwością na pergolidu mezylan lub inne pochodne sporyszu, lub
na dowolną substancję pomocniczą.
Nie stosować u koni w wieku poniżej 2 lat.
Specjalne ostrzeżenia:
W celu stwierdzenia rozpoznania PPID należy wykonać odpowiednie endokrynologiczne badania
laboratoryjne oraz ocenę objawów klinicznych.
Specjalne środki ostrożności dotyczące bezpiecznego stosowania u docelowych gatunków zwierząt: Ponieważ większość przypadków PPID rozpoznaje się u starszych koni, często występują też inne procesy patologiczne. Informacje dotyczące monitorowania i częstości badań, patrz punkt 8.
Specjalne środki ostrożności dla osób podających weterynaryjny produkt leczniczy zwierzętom:
Ten weterynaryjny produkt leczniczy może powodować podrażnienie oczu, drażniący zapach lub ból głowy po dzieleniu tabletek. Unikać kontaktu z oczami i wdychania podczas postępowaniu
z tabletkami. Zminimalizuj ryzyko narażenia podczas dzielenia lub rozpuszczania tabletek, np. tabletek nie należy rozgniatać. W przypadku kontaktu ze skórą, zmyć narażoną skórę wodą. W razie narażenia oczu niezwłocznie spłukać dotknięte oko wodą i uzyskać poradę lekarską. W przypadku podrażnienia nosa wyjść na świeże powietrze i uzyskać pomoc lekarską w przypadku wystąpienia trudności z oddychaniem.
Ten weterynaryjny produkt leczniczy może powodować reakcje nadwrażliwości (alergiczne). Osoby o znanej nadwrażliwości na pergolid lub inne pochodne sporyszu powinny unikać kontaktu
z weterynaryjnym produktem leczniczym.
Ten weterynaryjny produkt leczniczy może wywoływać zdarzenia niepożądane na skutek obniżonego poziomu prolaktyny, co stanowi szczególne ryzyko dla kobiet w ciąży i karmiących piersią. Kobiety
w ciąży i karmiące piersią powinny unikać kontaktu produktu ze skórą oraz przenoszenia go z dłoni do ust przez noszenie rękawiczek podczas podawania.
Przypadkowe połknięcie, w szczególności przez dzieci, może powodować zdarzenia niepożądane, takie jak wymioty, zawroty głowy, letarg lub obniżenie ciśnienia tętniczego krwi. Aby uniknąć przypadkowego połknięcia, starannie przechowywać weterynaryjny produkt leczniczy w miejscu niewidocznym i niedostępnym dla dzieci. Części tabletek należy umieścić z powrotem w otwartym gnieździe blistra. Blistry należy umieszczać z powrotem w opakowaniu zewnętrznym i przechowywać w bezpiecznym miejscu. Po przypadkowym połknięciu należy niezwłocznie zasięgnąć porady lekarza oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Nie jeść, nie pić ani nie palić podczas stosowania tego weterynaryjnego produktu leczniczego. Po użyciu umyć ręce.
Ciąża:
Bezpieczeństwo tego weterynaryjnego produktu leczniczego stosowanego u klaczy w ciąży nie zostało określone. Badania laboratoryjne na myszach i królikach nie dały żadnych dowodów działania teratogennego. Stwierdzono ograniczenie płodności u myszy przy dawce 5,6 mg/kg masy ciała na dobę. Stosować jedynie po dokonaniu przez lekarza weterynarii oceny stosunku korzyści do ryzyka.
Laktacja:
Nie zaleca się stosowania u koni w okresie laktacji, w którym to nie wykazano bezpieczeństwa stosowania tego weterynaryjnego produktu leczniczego. U myszy obniżona masa ciała i wskaźniki przeżywalności potomstwa przypisano farmakologicznemu hamowaniu wydzielania prolaktyny prowadzącemu do braku laktacji.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Należy zachować środki ostrożności w przypadku, gdy weterynaryjny produkt leczniczy podawany jest w skojarzeniu z innymi lekami silnie wiążącymi się z białkami osocza. Nie podawać równocześnie z antagonistami dopaminy, takimi jak neuroleptyki (fenotiazyny – np. acepromazyna) domperidon lub metoklopramid, ponieważ mogą one ograniczać skuteczność pergolidu.
Przedawkowanie:
Brak dostępnych informacji
Konie:
Rzadko (1 do 10 zwierząt/10 000 leczonych zwierząt): | Brak apetytu, przejściowy brak łaknienia i apatia, łagodne objawy ze strony ośrodkowego układu nerwowego (np. łagodna osowiałość i łagodna ataksja), biegunka i kolka. |
Bardzo rzadko (< 1 zwierzę/10 000 leczonych zwierząt, włączając pojedyncze raporty): | Potliwość. |
Zgłaszanie działań niepożądanych jest istotne, ponieważ umożliwia ciągłe monitorowanie
bezpieczeństwa stosowania weterynaryjnego produktu leczniczego. W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia
braku działania produktu, w pierwszej kolejności poinformuj o tym lekarza weterynarii. Można również zgłosić działania niepożądane do lokalnego przedstawiciela podmiotu odpowiedzialnego przy użyciu danych kontaktowych zamieszczonych w końcowej części tej ulotki lub poprzez krajowy
system zgłaszania: Departament Oceny Dokumentacji i Monitorowania Niepożądanych Działań Produktów Leczniczych Weterynaryjnych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C, PL-02-222 Warszawa, Polska Tel.:
+48 22 49-21-687 Faks: +48 22 49-21-605, strona internetowa: https://smz.ezdrowie.gov.pl
Podanie doustne, raz dziennie.
Dawka początkowa
Dawka początkowa wynosi ok. 2 μg pergolidu/kg (zakres dawki: od 1,7 do 2,5 µg/kg; patrz tabela poniżej). Dawkę podtrzymującą (od 0,6 do 10 µg pergolidu/kg masy ciała, średnio 2 µg pergolidu/kg masy ciała) należy dostosować odpowiednio do indywidualnej odpowiedzi, stwierdzonej na podstawie monitorowania (patrz poniżej).
Zaleca się następujące dawki początkowe:
Masa ciała konia kg | Liczba tabletek | Dawka początkowa mg/koni | Zakres dawkowania μg/kg |
200–300 | ½ | 0,50 | 1,7–2,5 |
301–400 | ¾ | 0,75 | 1,9–2,5 |
401–600 | 1 | 1,00 | 1,7–2,5 |
601–850 | 1 ½ | 1,50 | 1,8–2,5 |
851–1000 | 2 | 2,00 | 2,0–2,4 |
Dawka podtrzymująca
W przypadku tej choroby przewiduje się leczenie przez całe życia.
U większości koni reakcja na leczenie i stabilizacja następuje przy średniej dawce wynoszącej 2 µg pergolidu/kg masy ciała. Poprawy klinicznej po zastosowaniu pergolidu należy się spodziewać w
ciągu 6 do 12 tygodni. Odpowiedź kliniczna u koni może wystąpić przy niższych lub zmiennych dawkach, w związku z czym zaleca się stopniowe dostosowanie dawki do najniższej dawki skutecznej dla zwierzęcia na podstawie odpowiedzi na leczenie, niezależnie od tego, czy jest to skuteczność, czy objawy nietolerancji. W przypadku niektórych koni konieczna może być dawka sięgająca 10 µg pergolidu/kg masy ciała dziennie. W takich rzadkich przypadkach zalecane jest odpowiednie dodatkowe monitorowanie zwierzęcia.
W celu dostosowania dawki i monitorowania leczenia po początkowym rozpoznaniu należy powtarzać badania endokrynologiczne w odstępach 4–6 tygodni do czasu stabilizacji lub złagodzenia objawów klinicznych i (lub) poprawy wyników badań diagnostycznych.
Jeśli objawy kliniczne lub wyniki badań diagnostycznych nie ulegną poprawie po pierwszym okresie wynoszącym 4–6 tygodni, całkowitą dawkę dzienną można zwiększyć o 0.25 - 0,50 mg.
W przypadku, gdy objawy kliniczne uległy jedynie złagodzeniu, lekarz weterynarii może kontynuować dostosowywanie dawki aż do całkowitego ustabilizowania pacjenta, bądź też
zrezygnować z tego – w zależności od indywidualnej odpowiedzi na leczenie lub tolerancji produktu.
W przypadku, gdy objawy kliniczne nie są odpowiednio kontrolowane (na podstawie oceny klinicznej i (lub) testów diagnostycznych), zaleca się zwiększanie całkowitej dawki dobowej o 0.25 - 0,50 mg (jeśli lek jest tolerowany przy tej dawce) co 4 do 6 tygodni do czasu stabilizacji. W razie wystąpienia objawów nietolerancji dawki należy wstrzymać leczenie na 2–3 dni, a następnie wznowić, podając połowę poprzedniej dawki. Następnie można kontynuować zwiększanie całkowitej dawki dobowej
o 0.25 - 0,5 mg co 2–4 tygodnie do uzyskania pożądanego efektu klinicznego. W przypadku pominięcia dawki następną zaplanowaną dawkę należy podać zgodnie z zaleceniami.
Po uzyskaniu stabilizacji należy regularnie co 6 miesięcy powtarzać ocenę stanu klinicznego i badania diagnostyczne w celu monitorowania leczenia i dawki. W przypadku braku widocznej odpowiedzi na leczenie należy zweryfikować rozpoznanie i (lub) plan leczenia.
Tabletki można dzielić na 2 lub 4 równe części w celu zapewnienia dokładnego dawkowania. Położyć tabletkę na płaskiej powierzchni stroną z linią podziału do góry i wypukłą (zaokrągloną) stroną w dół.
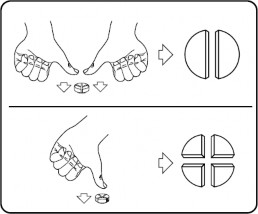
2 równe części: nacisnąć w dół kciukami po obu stronach tabletki. 4 równe części: nacisnąć w dół kciukiem pośrodku tabletki.
W celu ułatwienia podania należy umieścić wymaganą dzienną dawkę produktu w małej ilości wody i (lub) zmieszać z melasą lub innym słodzikiem, a następnie mieszać do rozpuszczenia. W takim przypadku rozpuszczone tabletki należy podać za pomocą strzykawki. Całą objętość należy podać natychmiast. Nie należy rozgniatać tabletek, patrz punkt 6. Po podzieleniu tabletek pozostałą część tabletki należy podać przy następnym podaniu.
Produkt niedopuszczony do stosowania u koni przeznaczonych do spożycia przez ludzi.
Koń musi zostać zadeklarowany jako zwierzę nieprzeznaczone do spożycia przez ludzi w ramach przepisów
krajowych dotyczących paszportów dla koni.
Produkt niedopuszczony do stosowania u klaczy produkujących mleko do spożycia przez ludzi.
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Brak specjalnych środków ostrożności dotyczących przechowywania.
Nie używać tego weterynaryjnego produktu leczniczego po upływie terminu ważności podanego na blistrze i pudełku po upływie „Termin ważności (Exp)”. Termin ważności oznacza ostatni dzień danego miesiąca.
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
Należy skorzystać z krajowego systemu odbioru odpadów w celu usunięcia niewykorzystanego weterynaryjnego produktu leczniczego lub materiałów odpadowych pochodzących z jego
zastosowania w sposób zgodny z obowiązującymi przepisami oraz właściwymi krajowymi systemami odbioru odpadów. Pomoże to chronić środowisko.
O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii lub farmaceutę.
Wydawany na receptę weterynaryjną
Blister OPA/Aluminium/PVC-Aluminium, zawierający 7 lub 10 tabletek. Pudełko tekturowe zawierające 60, 91, 100, 160 lub 240 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
{DD/MM/RRRR}
Szczegółowe informacje dotyczące powyższego weterynaryjnego produktu leczniczego są dostępne
w unijnej bazie danych produktów (https://medicines.health.europa.eu/veterinary).
Podmiot odpowiedzialny oraz wytwórca odpowiedzialny za zwolnienie serii: CP-Pharma Handelsgesellschaft mbH
Ostlandring 13
31303 Burgdorf Niemcy
Lokalny przedstawiciel oraz dane kontaktowe do zgłaszania podejrzeń działań niepożądanych: ScanVet Poland Sp. z o.o.
Skiereszewo, ul. Kiszkowska 9 62-200 Gniezno pharmacovigilance@scanvet.pl











