Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania do stosowania dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania Specjalne środki ostrożności dotyczące stosowania u zwierząt
Działania niepożądane (częstotliwość i stopień nasilenia)
Interakcje z innymi produktami leczniczymi weterynaryjnymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres (-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE:
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
EFFIPRO 50 mg roztwór do nakrapiania dla kotów
1 pipetka (0,5 ml) zawiera:
Substancja czynna:
Fipronil 50 mg
Substancje pomocnicze:
Butylhydroksyanizol E 320 0,1 mg
Butylhydroksytoluen E 321 0,05 mg
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Roztwór do nakrapiania
Roztwór przezroczysty, bezbarwny do żółtego
Koty
Zwalczanie inwazji pcheł (Ctenocephalides spp.) i kleszczy (Dermacentor reticulatus).
Produkt zapewnia skuteczną ochronę przed pchłami (Ctenocephalides felis) przez okres do 5 tygodni.
Produkt zapewnia skuteczne działanie roztoczobójcze przez okres do 2 tygodni - w przypadku kleszczy (Rhipicephalus sanguineus, Ixodes ricinus, Dermacentor reticulatus). W przypadku obecności kleszczy pewnych gatunków (Rhipicephalus sanguineus, Ixodes ricinus) podczas stosowania produktu, nie wszystkie kleszcze mogą być zabite w ciągu pierwszych 48 godz., ale mogą być zabite w ciągu tygodnia.
Produkt może być stosowany jako element strategii zwalczania APZS (Alergicznego pchlego zapalenia skóry), wcześniej zdiagnozowanego przez lekarza weterynarii.
Nie stosować u kociąt w wieku poniżej 2 miesięcy i/lub ważących mniej niż 1 kg w przypadku braku danych.
Nie stosować u zwierząt chorych (np. choroby układowe, gorączka) lub ozdrowieńców. Nie stosować u królików, ponieważ mogą pojawić się działania niepożądane, nawet śmierć.
Nie stosować w przypadku nadwrażliwości na substancję czynną lub na inne składniki produktu.
Pchły często zanieczyszczają kosze, legowiska zwierząt oraz inne miejsca odpoczynku zwierząt, jak dywany, meble tapicerowane, które w przypadku intensywnej inwazji na początku procesu zwalczania powinny być potraktowane odpowiednimi środkami owadobójczymi oraz powinny być regularnie odkurzane.
Produkt nie zabezpiecza przed przyczepieniem się kleszcza do ciała zwierzęcia. Jeśli produkt został zastosowany przed ekspozycją na kleszcze, kleszcze będą zabite w ciągu pierwszych 24 - 48 godzin od momentu przyczepienia. Zabicie będzie zwykle wcześniejsze niż pełne wszczepienie kleszcza w skórę, co zminimalizuje, choć nie wykluczy ryzyka przeniesienia choroby. Po zabiciu kleszcze zwykle spadają z ciała zwierzęcia, a te, które pozostaną, mogą być łatwo usunięte przez delikatne strzepnięcie.
Zaleca się unikania częstych kąpieli, ponieważ skuteczność produktu w takich sytuacjach nie była badana.
Gdy produkt jest stosowany jako element strategii zwalczania Alergicznego pchlego zapalenia skóry, zaleca się stosowanie produktu raz na miesiąc u zwierząt, u których występuje alergia oraz u innych kotów przebywających w domu.
Dla optymalnego zwalczania inwazji pcheł w domu, gdzie przebywa wiele zwierząt, u wszystkich psów i kotów w domu powinien być zastosowany odpowiedni środek owadobójczy.
Unikać kontaktu produktu z oczami zwierzęcia. W przypadku dostania się produktu do oka, natychmiast dokładnie przemyć oczy wodą.
Nie stosować produktu na rany czy na uszkodzoną skórę.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Produkt może powodować podrażnienie błon śluzowych i spojówki oka. Zatem należy unikać kontaktu produktu z jamą ustną i oczami.
W przypadku dostania się produktu do oka, natychmiast i dokładnie przemyć oczy wodą. Jeśli podrażnienie spojówki oka utrzymuje się, należy zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Unikać sytuacji mogących prowadzić do kontaktu produktu z dłońmi. W przypadku takiego kontaktu, umyć dłonie mydłem i wodą.
Myć ręce po zastosowaniu produktu.
Nie palić, nie pić i nie jeść podczas stosowania produktu.
Osoby o znanej nadwrażliwości na fipronil lub substancję pomocniczą powinny unikać kontaktu z produktem leczniczym weterynaryjnym.
Leczone zwierzęta nie powinny być dotykane do czasu wyschnięcia sierści, do tego również czasu dzieci nie powinny bawić się ze zwierzętami. Stąd zaleca się, by produktu nie stosować w ciągu dnia, lecz wieczorem oraz by te zwierzęta nie szły spać z właścicielami, szczególnie z dziećmi.
Inne ostrzeżenia
Składnik alkoholowy może mieć negatywny wpływ na malowane, lakierowane lub inne powierzchnie w domu lub na wyposażenie.
W przypadku lizania się zwierzęcia może dojść do wystąpienia krótkotrwałego nadmiernego ślinienia, zależnego głównie od składnika produktu.
Spośród wyjątkowo rzadko występujących działań niepożądanych mogą wystąpić w miejscu podania przemijające reakcje skórne (łuszczenie naskórka, miejscowe wyłysienia, świąd, zaczerwienienie) i ogólny świąd lub wyłysienia. Wyjątkowo mogą pojawić się: nadmierne ślinienie, odwracalne objawy neurologiczne (przeczulica, depresja, objawy nerwowe), wymioty.
4.7. Stosowanie w ciąży, laktacji lub w okresie nieśności
Badania laboratoryjne z użyciem fipronilu nie wykazały działania teratogennego czy embriotoksycznego. Nie przeprowadzono badań u kotek ciężarnych i w laktacji. Do stosowania w ciąży i w laktacji jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Nieznane
Droga podawania oraz dawkowanie:
Tylko do użytku zewnętrznego.
Podawać punktowo na skórę 1 pipetkę (0,5 ml) na zwierzę. Sposób podania:
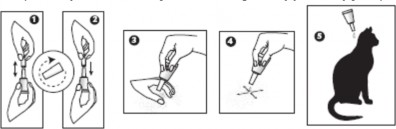
Pipetki termoformowalne:
Trzymać pipetkę czubkiem do góry. Uderzyć w wąską część pipetki tak, by mieć pewność, że cała zawartość znajduje się w jej głównej części. Ułamać czubek pipetki wzdłuż wyznaczonej linii.
Odgarnąć sierść tak, by była widoczna skóra. Umieścić końcówkę pipetki na odkrytej skórze i delikatnie nacisnąć ją kilka razy do czasu całkowitego opróżnienia. Powtórzyć tę czynność w 1 lub 2 różnych miejscach wzdłuż grzbietu kota, preferując nasadę głowy i okolicę miedzy łopatkami.
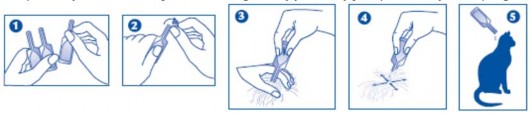
(Uwaga: kształt pipet wpływa na rodzaj obrazków umieszczonych na pudełku/ulotce informacyjnej.) Pipetki polipropylenowe:
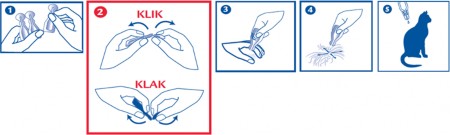
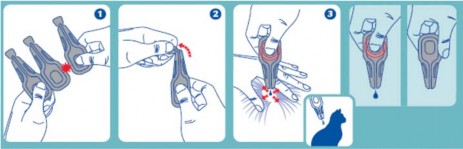
Wyjąć pipetkę z opakowania. Trzymać pipetkę nakrętką do góry, odkręcić i ściągnąć zakrętkę. Odwrócić zakrętkę i umieścić ją odwrotnym końcem na pipetce. Kręcić nakrętką aż do pokonania blokady, po czym usunąć nakrętkę z pipetki.
Odgarnąć sierść tak, by była widoczna skóra. Umieścić końcówkę pipetki na odkrytej skórze i delikatnie nacisnąć ją kilka razy do czasu całkowitego opróżnienia. Powtórzyć tę czynność w 1 lub 2 różnych miejscach wzdłuż grzbietu kota, preferując nasadę głowy i okolicę miedzy łopatkami.
Ważne jest by mieć pewność, że zwierzę nie będzie mogło polizać miejsca, gdzie zastosowano produkt oraz że zwierzęta nie będą mogły lizać się między sobą po jego zastosowaniu.
Należy unikać nadmiernego zmoczenia produktem sierści, ponieważ może to powodować sklejanie się sierści w miejscu podania produktu. Jednakże jeśli tak się stanie, po 24 godzinach od zastosowania powinno to zniknąć.
Białe osady mogą być widoczne w miejscu podania produktu do 48 godzin po jego zastosowaniu. Schemat stosowania:
Dla skutecznego zwalczania inwazji pcheł i/lub kleszczy schemat stosowania powinien uwzględniać
miejscową sytuację epidemiologiczną.
Z powodu braku odpowiednich badań bezpieczeństwa, minimalny okres między kolejnym zastosowaniem produktu powinien wynosić 4 tygodnie.
Nie obserwowano żadnych działań niepożądanych w badaniach bezpieczeństwa u kotów, 2 miesięcznych kociąt i starszych kociąt ważących około 1 kg – gdy produkt był stosowany w 5-krotnej dawce terapeutycznej (dzienna dawka terapeutyczna była stosowana przez 5 kolejnych dni) przez 3 kolejne miesiące, wyjątkowo pojawiły się świąd i wymioty. Ryzyko działań niepożądanych może wzrosnąć w przypadkach przedawkowania.
Nie dotyczy
Grupa farmakoterapeutyczna: do zwalczania pasożytów zewnętrznych, do stosowania miejscowego kod ATCvet: QP53AX15
Fipronil jest związkiem owadobójczym i roztoczobójczym należącym do grupy fenylopirazoli. Mechanizm działania związany jest z blokowaniem kompleksu GABA, połączonego z kanałem chlorowym i w ten sposób dochodzi do blokowania pre- i post-synaptycznego przepływu jonów chlorowych przez błonę komórkową. Prowadzi to do niekontrolowanej aktywności centralnego układu nerwowego i śmierci owadów lub roztoczy.
Fipronil wykazuje u kotów działanie owadobójcze i roztoczobójcze przeciwko pchłom (Ctenocephalides spp) i kleszczom (Rhipicephalus spp., Dermacentor spp., Ixodes spp. włączając Ixodes ricinus).
Pchły będą zabite w ciągu 24 godz. Kleszcze zwykle będą zabite w ciągu 48 godz. od kontaktu z fipronilem, jakkolwiek w przypadku obecności kleszczy pewnych gatunków (Rhipicephalus sanguineus i Ixodes ricinus) podczas stosowania produktu, nie wszystkie kleszcze mogą być zabite w ciągu pierwszych 48 godz.
W badaniach in vitro fipronil jest w głównej mierze metabolizowany do pochodnej sulfonowej. Jednakże, proces ten może być ograniczony in vivo, ponieważ fipronil jest słabo wchłaniany u kotów. Stężenie fipronilu na sierści obniża się z czasem.
Butylhydroksyanizol E320 Butylhydroksytoluen E321 Alkohol benzylowy
Glikolu dietylenowego monoetylowy eter
Nieznane
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: pipetki termoformowalne, bez blistra: 2 lata
pipetki termoformowalne, w blistrze: 3 lata pipetki polipropylenowe: 2 lata.
Przechowywać w temperaturze poniżej 30˚ C. Przechowywać w suchym miejscu.
Przechowywać w oryginalnym opakowaniu.
Nie wyjmować z blistra do czasu zastosowania produktu.
Pipetki termoformowalne:
Białe lub przezroczyste, wielowarstwowe, plastikowe, jednodawkowe pipetki o objętości 0,5 ml. Wewnętrzna warstwa pozostająca w kontakcie z produktem jest wyprodukowana z poliakrylonitrilo – metakrylanu lub polietylenu-alkoholu etylowinylowego-polietylenu.
Biała lub przezroczysta zewnętrzna warstwa składa się z warstw: polipropylen / cykliczne kopolimery olefinowe / polipropylen. Pudełka zawierają pipetki w indywidulanym blistrze lub bez blistra.
Pudełka zawierające 1, 2, 3, 4, 6, 8, 12, 24, 30, 60, 90 lub 150 pipetek.
Pipetki polipropylenowe:
Białe, polipropylenowe, jednodawkowe pipetki o objętości 0,5 ml, zapakowane w bezbarwne plastikowe blistry składające się z warstw: polipropylen / cykliczne kopolimery olefinowe / polipropylen, zamknięte przez zgrzewanie termiczne termozgrzewalnej, lakierowanej folii aluminiowej i umieszczone w tekturowych pudełkach lub blistrach.
Blistry lub pudełka zawierające 1, 2, 3, 4, 6, 8, 12, 24, 30, 60, 90 lub 150 pipetek. Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Produkt nie powinien się przedostawać do cieków wodnych, ponieważ może być niebezpieczny dla ryb i innych organizmów wodnych. Nie zanieczyszczać produktem czy pustymi opakowaniami stawów, cieków wodnych lub rowów.
VIRBAC S.A.
1 ère avenue 2065 m LID
06516 Carros Francja
+ 33 (0) 4 92 08 73 04
+ 33 (0) 4 92 08 73 48
1901/09
/ DATA PRZEDŁUŻENIA POZWOLENIA
28.04.2009











