Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Amflee 50 mg roztwór do nakrapiania dla kotów
1 pipetka (0,50 ml) zawiera:
Substancja czynna:
Fipronil 50 mg
Substancje pomocnicze:
Butylohydroksyanizol (E320) 0,10 mg
Butylohydroksytoluen (E321) 0,05 mg
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Roztwór do nakrapiania Roztwór o barwie jasnożółtej
Koty
Leczenie i zapobieganie inwazji pcheł (Ctenocephalides felis), kleszczy (Rhipicephalus spp.,
Dermacentor spp., Ixodes spp.) i wszołów (Felicola subrostratus) u kotów.
Produkt wykazuje trwałe działanie insektobójcze przez okres do 5 tygodni wobec pcheł i działanie bójcze do 2 tygodni wobec kleszczy.
Produkt może być stosowany jako element strategii leczenia alergicznego pchlego zapalenia skóry (APZS), o ile zostało ono wcześniej rozpoznane przez lekarza weterynarii.
Ze względu na brak dostępnych danych produktu nie należy stosować u kociąt w wieku poniżej 8 tygodni lub ważących mniej niż 1 kg.
Nie stosować produktu u zwierząt chorych (cierpiących na choroby ogólne, gorączkę) lub u zwierząt w okresie rekonwalescencji.
Nie stosować produktu u królików ze względu na ryzyko wystąpienia działań niepożądanych, a nawet zgonu.
Nie stosować u zwierząt z nadwrażliwością na substancję czynną lub na dowolną substancję pomocniczą.
Przed użyciem produktu należy usunąć ze zwierzęcia kleszcze w celu zmniejszenia ryzyka przeniesienia chorób.
Nie ma danych dotyczących skuteczności produktu po kąpieli/umyciu zwierzęcia szamponem w przypadków kotów. Niemniej jednak, na podstawie informacji dotyczących skuteczności u psów, które umyto szamponem 2 dni po podaniu produktu, nie zaleca się kąpania kotów przez 2 dni po podaniu produktu.
Pomimo podania produktu możliwe jest zagnieżdżanie się pojedynczych kleszczy, zatem nie można całkowicie wykluczyć ryzyka transmisji chorób zakaźnych w niekorzystnych
warunkach. Zakłada się, że kleszcze zostaną zabite i odpadną z gospodarza w ciągu 24 do 48 godzin po inwazji, z powodu braku dostępu do jego krwi jako pokarmu. Zagnieżdżenie
pojedynczych kleszczy po zastosowaniu produktu nie może być wykluczone.
Pchły atakujące zwierzęta występują także w legowiskach oraz miejscach, w których często przebywają, takich jak dywany oraz miękka tapicerka, które w przypadkach masowej inwazji oraz na początku działań kontrolnych powinny być również poddawane działaniu
odpowiednich preparatów owadobójczych i regularnie odkurzane za pomocą odkurzacza.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Bardzo ważne jest, by podać produkt w miejscu, z którego zwierzę nie może go zlizać, oraz nie dopuścić do wylizywania go przez inne zwierzęta, z którymi przebywa.
Chronić oczy zwierzęcia przed kontaktem z produktem.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Produkt może wywołać podrażnienie błon śluzowych i oczu. Należy chronić usta i oczy przed kontaktem z produktem.
Osoby o znanej nadwrażliwości na środki owadobójcze lub alkohol powinny unikać kontaktu z produktem leczniczym weterynaryjnym. Należy unikać bezpośredniego kontaktu produktu z dłońmi. W przypadku, gdy taki kontakt miał miejsce, należy umyć dłonie wodą i mydłem.
Jeśli dojdzie do przypadkowego kontaktu produktu z oczami, należy przepłukać je bieżącą wodą.
Po podaniu produktu należy umyć ręce.
Należy unikać dotykania leczonych zwierząt i nie należy zezwalać dzieciom na zabawę z nimi, aż do momentu wyschnięcia miejsca zastosowania produktu. Dlatego też zaleca się podanie produktu zwierzęciu w godzinach wieczornych. Wkrótce po zabiegu zwierzęta nie powinny spać z właścicielami, a w szczególności z dziećmi.
Podczas podawania produktu nie należy palić, pić ani jeść.
Jeżeli dojdzie do zlizania produktu może pojawić się krótkotrwałe ślinienie wywołane działaniem nośnika. Bardzo rzadko obserwowano również przejściowe reakcje skórne w miejscu podania (odbarwienie skóry i utrata sierści, świąd, zaczerwienienie skóry) oraz
uogólniony świąd i wyłysienia. Czasami obserwowano nadmierne ślinienie się, odwracalne objawy neurologiczne (przeczulica, depresja, nerwowość) lub wymioty.
Należy unikać przedawkowania.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Bezpieczeństwo produktu zostało zbadane u kotów hodowlanych, ciężarnych oraz w okresie laktacji, którym podano dawkę trzykrotnie większą od zalecanej. Produkt może być podawany hodowlanym i ciężarnym kotom oraz kotom w okresie laktacji.
Nieznane.
Dawkowanie:
Należy podać zawartość 1 pipety jednodawkowej o pojemności 0,5 ml na skórę między łopatkami.
Droga podawania: Podanie przez nakrapianie.
Sposób podawania:
Należy wyjąć pipetkę jednodawkową z opakowania. Trzymając pipetkę w pozycji pionowej, odkręcić i zdjąć końcówkę. Odwrócić końcówkę i umieścić drugim końcem na pipetce.
Nacisnąć i przekręcić końcówkę, aby przebić zamknięcie, po czym zdjąć ją z pipetki.
Odgarnąć sierść zwierzęcia na grzbiecie pomiędzy łopatkami tak, aby widoczna była skóra. Przyłożyć koniec pipetki do skóry i kilkukrotnie ścisnąć, w celu wyciśnięcia jej zawartości bezpośrednio na skórę.
Ze względu na brak odpowiednich badań dotyczących bezpieczeństwa minimalny okres pomiędzy kolejnymi zabiegami wynosi 4 tygodnie.
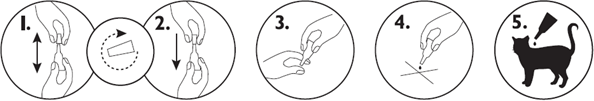
Należy uważać, aby nie zwilżyć nadmiernie produktem sierści, ponieważ spowoduje to posklejanie włosów w miejscu podawania produktu. Gdyby jednak do tego doszło, efekt ten ustępuje w ciągu 24 godzin po podaniu produktu.
Badania laboratoryjne dotyczące bezpieczeństwa produktu u gatunków docelowych, prowadzone na kotach i kociętach w wieku 8 tygodni i starszych o masie ciała około 1 kg, którym przez 6 miesięcy podawano comiesięcznie dawki pięciokrotnie większą od zalecanych, nie wykazały żadnych działań niepożądanych. Jednakże ryzyko wystąpienia działań niepożądanych wzrasta w przypadku przedawkowania (patrz punkt 4.6)
Po podaniu produktu może wystąpić świąd.
Nie dotyczy.
Grupa farmakoterapeutyczna: Środki do zwalczania pasożytów zewnętrznych, do podania miejscowego
Kod ATC vet: QP53AX15
Fipronil jest środkiem owadobójczym/roztoczobójczym należącym do grupy fenylopirazoli. Niszczy on stawonogi poprzez interakcję z ligandami kanałów chlorkowych, zwłaszcza tymi regulowanymi przez neurotransmiter kwasu gamma aminomasłowego (GABA). Blokuje w ten sposób pre- i postsynaptyczny transfer jonów chlorowych przez błony komórkowe, czego wynikiem jest niekontrolowana aktywność ośrodkowego układu nerwowego i śmierć owadów lub roztoczy.
Produkt ten zawiera substancję czynną fipronil, która posiada unikalny mechanizm działania przeciwko pchłom i kleszczom. Gromadzi się ona w lipidowej strukturze skóry i mieszkach włosowych, skąd jest sukcesywnie wydzielana na powierzchnię skóry i sierści, co zapewnia długoterminowe działanie produktu.
Całkowita dawka fipronilu wchłonięta przez skórę po miejscowym podaniu produktu jest bardzo mała.
Po podaniu produktu, fipronil rozprzestrzenia się za pośrednictwem gradientu stężeń w skórze i sierści zwierząt od miejsca podania do obszarów peryferyjnych (lędźwiowych, bocznych, itd.) Fipronil nie jest wchłaniany, a zatem nie jest metabolizowany w organizmie.
Stężenie fipronilu w sierści spada i 2 miesiące po podaniu osiąga poziom 1 µg/g.
Butylohydroksytoluen (E321) Butylohydroksyanizol (E320) Etanol 96%
Polisorbat 80 Powidon K25
Glikolu dietylowego monoetylowy eter
Nieznane.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 3 lata.
Przechowywać w opakowaniu oryginalnym w celu ochrony przed światłem.
Brak szczególnych środków ostrożności dotyczących temperatury przechowywania produktu leczniczego weterynaryjnego.
Pipetka (PP), zamknięcie z przebijakiem (PE lub POM): pipetki jednodawkowe zawierające 0,50 ml roztworu do nakrapiania w trójwarstwowej saszetce (PETP/Al/LDPE).
Pudełko tekturowe zawiera 1, 3, 6, 10 lub 20 pipetek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Produkt Amflee roztwór do nakrapiania dla kotów nie powinien się przedostawać do cieków wodnych, ponieważ może być niebezpieczny dla ryb i innych organizmów wodnych.
KRKA, d.d., Novo mesto Šmarješka cesta 6
8501 Novo mesto Słowenia
2329/14
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 31.01.2014 r.
Data przedłużenia pozwolenia:
ZAKAZ SPRZEDAŻY, DOSTAWY I/LUB STOSOWANIA, JEŻELI DOTCZY
Nie dotyczy











