Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Modulis 100 mg/ml roztwór doustny dla psów Modulis 100 mg/ml (FR)
Modulis vet 100 mg/ml oral solution for dogs (DK, SE, FI, NO)
Każdy ml zawiera:
Substancja czynna:
Cyklosporyna 100 mg
Substancje pomocnicze:
all-rac-α-tokoferol (E307) 1 mg Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Roztwór doustny
Klarowny do lekko żółtego, opalizujący roztwór. Widoczna może być mgiełka, niewielkie płatki lub
nieznaczny osad.
Psy
Leczenie przewlekłych objawów atopowego zapalenia skóry u psów.
Nie stosować w przypadkach nadwrażliwości na cyklosporynę lub na dowolną substancję pomocniczą. Nie stosować u psów poniżej 6 miesiąca życia, ani u psów o masie ciała poniżej 2 kg.
Nie stosować w przypadku występowania w historii chorób nowotworowych lub postępujących
chorób nowotworowych.
Nie szczepić żywymi szczepionkami w trakcie leczenia, ani w odstępie 2 tygodni przed lub po podaniu produktu (patrz także punkt 4.5 „Specjalne środki ostrożności dotyczące stosowania” i 4.8
„Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji”).
Podczas rozpoczynania leczenia cyklosporyną należy rozważyć zastosowanie innych środków i/lub leczenia w celu kontrolowania świądu umiarkowanego do ciężkiego.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Objawy kliniczne atopowego zapalenia skóry, takie jak świąd i stan zapalny skóry, nie są specyficzne dla tej choroby i z tego względu przed zastosowaniem leczenia należy wykluczyć inne możliwe
przyczyny zapalenia skóry, np. inwazje ektopasożytów, inne alergie powodujące wystąpienie objawów skórnych (np. alergiczne pchle zapalenie skóry czy alergia pokarmowa), zakażenia
bakteryjne i grzybicze. Dobrą praktyką jest zwalczanie inwazji pcheł przed, jak i w trakcie leczenia atopowego zapalenia skóry.
Przed podaniem produktu leczniczego weterynaryjnego zaleca się zwalczenie infekcji bakteryjnych i grzybiczych. Jednakże wystąpienie infekcji w trakcie leczenia nie musi być powodem zaprzestania podawania leku, o ile infekcja nie jest ciężka.
Przed rozpoczęciem leczenia należy wykonać pełne badanie kliniczne. Z uwagi na fakt, iż cyklosporyna hamuje czynność limfocytów T, to chociaż nie wywołuje ona nowotworów, może jednak prowadzić do zwiększenia częstotliwości występowania klinicznie widocznych nowotworów, ze względu na zmniejszenie odpowiedzi immunologicznej przeciwnowotworowej.
Należy regularnie monitorować limfadenopatię występującą podczas leczenia cyklosporyną.
Wykazano, iż u zwierząt laboratoryjnych cyklosporyna może mieć wpływ na poziom insuliny we krwi i powodować wzrost glikemii. W przypadku występowania objawów sugerujących cukrzycę, należy monitorować wpływ leczenia na poziom glikemii. Jeśli pojawią się objawy cukrzycy po podaniu produktu, takie jak poliuria czy polidypsja, należy zmniejszyć dawkę lub odstawić lek i zasięgnąć porady lekarza weterynarii. Nie zaleca się stosowania cyklosporyny u psów chorujących na cukrzycę. U psów z ciężką niewydolnością nerek należy ściśle monitorować poziom kreatyniny.
Szczególną uwagę należy zwrócić na szczepienia. Stosowanie produktu leczniczego weterynaryjnego może wpływać na skuteczność szczepień. Nie zaleca się stosowania szczepionek inaktywowanych w czasie leczenia, ani w odstępie 2 tygodni przed lub po podaniu produktu. Podawanie szczepionek
żywych – patrz punkt 4.3 „Przeciwwskazania”.
Nie zaleca się stosowania jednoczesnego z innymi lekami immunosupresyjnymi.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Przypadkowe połknięcie produktu może prowadzić do nudności i/lub wymiotów. Aby uniknąć przypadkowego spożycia, produkt musi być stosowany i przechowywany w miejscu niedostępnym dla dzieci. Nie należy zostawiać napełnionej strzykawki bez nadzoru w obecności dzieci. Po
przypadkowym połknięciu, zwłaszcza przez dziecko, należy niezwłocznie zwrócić się o pomoc
lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Cyklosporyna może wywoływać reakcje nadwrażliwości (alergiczne). Osoby o znanej nadwrażliwości na cyklosporynę powinny unikać kontaktu z produktem leczniczym weterynaryjnym.
Podrażnienie oczu jest mało prawdopodobne. Jako środek ostrożności unikać kontaktu z oczami. W
przypadku kontaktu, należy dokładnie spłukać czystą wodą. Po użyciu umyć ręce i narażoną skórę.
Zaburzenia żołądkowo-jelitowe, takie jak wymioty, raportowano rzadko w spontanicznych
zgłoszeniach. Biegunka, ospałość, anoreksja, zaburzenia ze strony dziąseł i podrażnienie małżowin
usznych raportowano bardzo rzadko w spontanicznych zgłoszeniach.
Objawy te mają charakter łagodny i przemijający i na ogół nie wymagają przerwania leczenia.
W spontanicznych zgłoszeniach bardzo rzadko raportowano wystąpienie cukrzycy, głównie u psów rasy West Highland White Terrier.
Podczas badań rozwojowych często obserwowano wystąpienie śluzowatych lub luźnych stolców, ale
objawy te nie były zgłaszane w spontanicznych raportach.
Nadpobudliwość, zmiany skórne, takie jak pojawienie się zmian brodawkowatych lub zmiana sierści, słabość mięśni lub skurcze mięśni były obserwowane niezbyt często podczas badań rozwojowych.
Objawy te nie były zgłaszane w spontanicznych raportach. Objawy te zazwyczaj ustępują samoistnie
po zaprzestaniu leczenia.
Informacje na temat chorób nowotworowych – patrz punkt 4.3 „Przeciwwskazania” i 4.5 „Specjalne środki ostrożności dotyczące stosowania”.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
U zwierząt laboratoryjnych, po podaniu dawek toksycznych dla samicy (u szczurów 30 mg/kg m.c., a u królików 100 mg/kg m.c.) cyklosporyna wykazała działanie embriotoksyczne i toksyczne dla płodu, o czym świadczyła zwiększona śmiertelność w okresie pre- i postnatalnym oraz obniżona masa płodu wraz z niedorozwojem układu szkieletowego. W zakresie dobrze tolerowanych dawek (u szczurów do 17 mg/kg m.c., a u królików do 30 mg/kg m.c.) nie stwierdzono zwiększenia śmiertelności zarodków ani działania teratogennego cyklosporyny. Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego u samców przeznaczonych do rozrodu, ani u samic w czasie ciąży i laktacji, nie zostało określone. Ze względu na brak takich badań u psów, zaleca się stosowanie produktu u zwierząt hodowlanych tylko po pozytywnej ocenie bilansu korzyści/ryzyka wynikającego ze stosowania produktu, dokonanej przez lekarza weterynarii. Cyklosporyna przenika barierę łożyskową i jest wydalana z mlekiem. Z tego względu nie zaleca się stosowania u suk w czasie laktacji.
Wiele substancji znanych jest z konkurencyjnego hamowania lub indukcji enzymów biorących udział w metabolizmie cyklosporyny, w szczególności cytochromu P450 (CYP 3A 4). W niektórych, klinicznie uzasadnionych przypadkach, konieczne może być dostosowanie dawki produktu leczniczego weterynaryjnego. Ketokonazol podawany psom w dawce 5-10 mg/kg zwiększa stężenie cyklosporyny we krwi do pięciu razy, co jest istotne klinicznie. Podczas jednoczesnego stosowania ketokonazolu i cyklosporyny lekarz weterynarii powinien rozważyć jako praktyczną miarę, dwukrotne zwiększanie odstępu czasu między kolejnymi podaniami, jeśli pies otrzymuje leki codziennie.
Makrolidy, jak erytromycyna, mogą nawet dwukrotnie zwiększać stężenie cyklosporyny w osoczu. Niektóre induktory cytochromu P450, leki przeciwdrgawkowe i antybiotyki (np. trimetoprim/ sulfadymidyna) mogą obniżać stężenie cyklosporyny w osoczu.
Cyklosporyna jest substratem i inhibitorem transportera: glikoproteina P (MDR1). Z tego względu jednoczesne podawanie cyklosporyny i substratów glikoproteiny P, takich jak makrocykliczne laktony (np. iwermektyna i milbemycyna) może powodować zmniejszenie usuwania tych leków z komórek bariery krew-mózg, potencjalnie prowadząc do wystąpienia objawów toksyczności ze strony ośrodkowego układu nerwowego.
Cyklosporyna może zwiększać nefrotoksyczność antybiotyków aminoglikozydowych i trimetoprimu. Jednoczesne stosowanie tych substancji czynnych z cyklosporyną nie jest zalecane.
Szczególną uwagę należy zwrócić na szczepienia (patrz punkt 4.3 „Przeciwwskazania” i 4.5
„Specjalne środki ostrożności dotyczące stosowania”). Jednoczesne stosowanie ze środkami
immunosupresyjnymi: patrz punkt 4.5 „Specjalne środki ostrożności dotyczące stosowania”.
Podanie doustne
Przed rozpoczęciem leczenia należy dokonać oceny wszystkich alternatywnych opcji leczenia. Średnia zalecana dawka cyklosporyny wynosi 5 mg/kg masy ciała, co odpowiada 0,5 ml roztworu na 10 kg masy ciała.
Produkt leczniczy weterynaryjny początkowo podaje się codziennie, do czasu wystąpienia znacznej poprawy klinicznej. Zazwyczaj następuje to w ciągu 4 tygodni. W przypadku braku odpowiedzi na leczenie w ciągu pierwszych 8 tygodni, leczenie należy przerwać.
Gdy objawy kliniczne atopowego zapalenia skóry będą pod zadowalającą kontrolą, preparat można podawać co drugi dzień, jako dawkę podtrzymującą. Lekarz weterynarii powinien regularnie przeprowadzać ocenę kliniczną i dostosowywać częstotliwość podawania zależnie od uzyskanej odpowiedzi klinicznej.
W niektórych przypadkach, gdy dawka podawana co drugi dzień ustabilizuje występowanie objawów klinicznych, lekarz weterynarii może zalecić podawanie produktu leczniczego weterynaryjnego co 3 - 4 dni. W celu utrzymania remisji objawów klinicznych należy stosować najniższą skuteczną
częstotliwość dawkowania.
Przed zmniejszeniem odstępu czasu pomiędzy podaniami leku można rozważyć wprowadzenie terapii wspomagającej (np. szampony lecznicze, niezbędne nienasycone kwasy tłuszczowe). Pacjenci powinni być regularnie poddawani ponownej ocenie i alternatywne opcje leczenia powinny być rozważane.
Leczenie można przerwać, gdy objawy kliniczne będą pod kontrolą. W razie nawrotu objawów klinicznych należy wznowić codzienne podawanie produktu, a w niektórych przypadkach wymagane może być powtórzenie całego leczenia.
Produkt leczniczy weterynaryjny należy podawać co najmniej 2 godziny przed lub po karmieniu. Produkt podaje się bezpośrednio do jamy ustnej.
Instrukcja stosowania
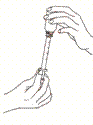
Naciśnij i odkręć zakrętkę butelki.
Włóż strzykawkę dozującą w specjalną plastikową wkładkę.
| Odwróć butelkę/strzykawkę do góry dnem i powoli pociągnij tłok, aż biała linia na tłoku odpowiadać będzie dawce zaleconej przez lekarza weterynarii. Strzykawka jest wyskalowana w kg i ml. |
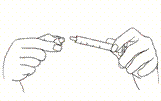
Wciskając tłok, wyciśnij zawartości strzykawki bezpośrednio do jamy ustnej. Wprowadź strzykawkę z boku jamy ustnej lub ponad język.
W razie konieczności, wytrzyj zewnętrzną część strzykawki suchą chusteczką i natychmiast wyrzuć zużytą chusteczkę. Zamknij butelkę, a na strzykawkę nałóż specjalną nasadkę w celu ochrony przed wszelkimi zanieczyszczeniami oraz by uniknąć rozlania pozostałości produktu. |
|
Fiolki 5 i 15 ml
Objętość podawana za pomocą 1 ml strzykawki: 0,05 ml/kg, czyli 1 podziałka/kg.
Fiolki 30 i 50 ml
Objętość podawana za pomocą 2 ml strzykawki: 0,1 ml/2 kg, czyli 1 podziałka/2 kg
U psów po podaniu pojedynczej dawki doustnej do 6-razy większej od zalecanej nie obserwowano
żadnych objawów niepożądanych, poza widocznymi także po podaniu produktu w dawkach zalecanych. Po podawaniu produktu przez 3 miesiące i dłużej w dawce 4-krotnie większej od średniej zalecanej, oprócz objawów obserwowanych po podaniu produktu w dawkach zalecanych, notowano wystąpienie następujących działań niepożądanych: hiperkeratozę, szczególnie na uszach, zmiany
przypominające zgrubienia na opuszkach łap, spadek masy ciała lub zmniejszony przyrost wagi, hipertrichozę, wzrost wskaźnika sedymentacji erytrocytów, obniżenie wartości eozynofili. Częstość występowania i nasilenie tych objawów są zależne od dawki.
Brak jest specyficznego antidotum i w przypadku wystąpienia objawów przedawkowania u psów
należy zastosować leczenie objawowe. Objawy są odwracalne i ustępują w ciągu 2 miesięcy od
zakończenia leczenia.
Nie dotyczy
Grupa farmakoterapeutyczna: Środki przeciwnowotworowe i immunomodulujące, środki
immunosupresyjne, inhibitory kalcyneuryny, cyklosporyna Kod ATC vet: QL04AD01
Cyklosporyna (znana również jako cyklosporyna A, CsA) jest selektywnym immunosupresorem. Jest to cykliczny polipeptyd, składający się z 11 aminokwasów, posiadający masę cząsteczkową 1203 daltony i oddziałujący specyficznie i w sposób odwracalny na limfocyty T.
Cyklosporyna wykazuje działanie przeciwzapalne i przeciwświądowe w leczeniu atopowego zapalenia skóry. Wykazano, iż cyklosporyna preferencyjnie hamuje aktywację limfocytów T stymulowaną antygenami, zaburzając wytwarzanie IL-2 i innych cytokin komórek T. Cyklosporyna posiada także
zdolność hamowania funkcji prezentowania antygenów przez układ immunologiczny skóry. Ponadto blokuje ona także rekrutację i aktywację eozynofili, produkcję cytokin przez keratynocyty, funkcje komórek Langerhansa, degranulację komórek tucznych, a tym samym uwalnianie histaminy i cytokin prozapalnych.
Cyklosporyna nie obniża hematopoezy i nie ma wpływu na funkcję komórek fagocytarnych.
Wchłanianie
Biodostępność cyklosporyny wynosi około 35%. Maksymalne stężenie w osoczu osiągane jest w ciągu 1 do 2 godzin. Biodostępność jest lepsza i mniej różni się indywidualnie, w przypadku podawania cyklosporyny przegłodzonym zwierzętom niż w czasie posiłków.
Dystrybucja
U psów objętość dystrybucji wynosi około 7,8 l/kg. Cyklosporyna jest szeroko dystrybuowana do wszystkich tkanek. Po wielokrotnym codziennym podawaniu psom stężenie cyklosporyny w skórze jest kilkukrotnie wyższe niż we krwi.
Metabolizm
Cyklosporyna jest metabolizowana głównie w wątrobie przez cytochrom P450 (CYP 3A 4), ale także w jelitach. Metabolizm odbywa się głównie na drodze hydroksylacji i demetylacji, prowadząc do powstania mało aktywnych lub nieaktywnych metabolitów. W ciągu pierwszych 24 godzin niezmieniona cyklosporyna stanowi około 25% stężenia we krwi.
Wydalanie
Wydalanie jest głównie z kałem. Tylko 10% jest wydalane z moczem, głównie w postaci metabolitów. Nie obserwowano znacznej akumulacji we krwi psów leczonych przez okres jednego roku.
All-rac-α-tokoferol (E307) Etanol, bezwodny (E1510) Glikol propylenowy (E1520)
Makrogologlicerolu hydroksystearynian Glicerolu monolinoleinian
Ponieważ nie wykonywano badań dotyczących zgodności, tego produktu leczniczego weterynaryjnego nie wolno mieszać z innymi produktami leczniczymi weterynaryjnymi.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 30 miesięcy. Okres ważności po pierwszym otwarciu opakowania bezpośredniego: 3 miesiące.
Butelkę przechowywać w opakowaniu zewnętrznym. Unikać przechowywania w lodówce.
Produkt zawiera składniki tłuszczowe pochodzenia naturalnego, które w niższych temperaturach mogą zmienić stan skupienia na stały. W temperaturze poniżej 20°C produkt może nabrać konsystencji podobnej do żelu, jest to jednak odwracalne w temperaturze do 30°C. Nadal mogą być widoczne
niewielkie płatki lub nieznaczny osad. Nie ma to jednak wpływu na dawkowanie ani na skuteczność i bezpieczeństwo produktu.
Bursztynowa butelka ze szkła typu III, zamykana zakrętką z HDPE z zabezpieczeniem przed dziećmi, wyposażoną w przezroczystą wkładkę z LDPE oraz strzykawka doustna (przezroczysty korpus z polipropylenu i biały tłoczek z HDPE) z białą nasadką z polipropylenu.
Butelka o pojemności 5 ml i strzykawka doustna o pojemności 1 ml w pudełku tekturowym Butelka o pojemności 15 ml i strzykawka doustna o pojemności 1 ml w pudełku tekturowym Butelka o pojemności 30 ml i strzykawka doustna o pojemności 2 ml w pudełku tekturowym Butelka o pojemności 50 ml i strzykawka doustna o pojemności 2 ml w pudełku tekturowym
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z
obowiązującymi przepisami.
Ceva Animal Health Polska Sp. z o.o. ul. Okrzei 1A, 03-715 Warszawa
2597/16
OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 05.12.2016 r.
Data przedłużenia pozwolenia: 17.12.2019 r.
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB
STOSOWANIA
Nie dotyczy