Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Doxybactin 50 mg tabletki dla psów i kotów
Doxybactin 50 mg tablets for dogs and cats (AT, BE, CY, CZ, DE, EL, ES, FR, HR, HU, IE, IT, LU, NL, PT, RO, SI, SK, UK)
Doxybactin vet 50 mg tablets for dogs and cats (DK, FI, IS, NO, SE, EE, LT, LV)
Każda tabletka zawiera:
Substancja czynna:
Doksycyklina (w postaci doksycykliny hyklanu) 50 mg
Substancja(e) pomocnicza(e):
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Tabletka.
Żółta z brązowymi kropkami, okrągła i wypukła, aromatyzowana tabletka z linią podziału w kształcie krzyża z jednej strony. Tabletki można podzielić na 2 lub 4 równe części.
Psy i koty.
Leczenie następujących chorób wywołanych przez bakterie wrażliwe na doksycyklinę:
Psy:
Nieżyt nosa wywołany przez Bordetella bronchiseptica i Pasteurella spp.; Odoskrzelowe zapalenie płuc wywołane przez Bordetella spp. i Pasteurella spp.; Śródmiąższowe zapalenie nerek wywołane przez Leptospira spp.
Koty:
Zakażenia dróg oddechowych wywołane przez Bordetella bronchiseptica, Chlamydophila felis i
Pasteurella spp.
Nie stosować w przypadkach nadwrażliwości na tetracykliny lub na dowolną substancję pomocniczą.
Brak.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Zwierzętom z dysfagią lub chorobami, którym towarzyszą wymioty, produkt należy podawać
z zachowaniem ostrożności, ponieważ podawanie tabletek zawierających doksycykliny hyklan zostało powiązane z występowaniem nadżerek przełyku.
W celu zmniejszenia prawdopodobieństwa wystąpienia podrażnienia przełyku i innych żołądkowo-jelitowych działań niepożądanych, produkt należy podawać razem z pożywieniem. Należy zachować szczególną ostrożność podczas podawania produktu zwierzętom z chorobami wątroby, ponieważ u niektórych zwierząt udokumentowano zwiększenie aktywności enzymów wątrobowych po leczeniu doksycykliną.
Młodym zwierzętom produkt należy podawać z zachowaniem ostrożności, ponieważ tetracykliny mogą powodować trwałe przebarwienie zębów w przypadku podawania podczas ich rozwoju.
Piśmiennictwo dotyczące ludzi wskazuje jednak, że w przypadku doksycykliny istnieje mniejsze prawdopodobieństwo spowodowania tych nieprawidłowości niż w przypadku innych tetracyklin, ponieważ doksycyklina ma mniejszą zdolność chelatowania wapnia.
Stosowanie produktu powinno opierać się na identyfikacji i badaniu wrażliwości patogenów docelowych. Jeśli nie jest to możliwe, terapia powinna opierać się na informacjach epidemiologicznych i wiedzy o podatności docelowych patogenów na poziomie lokalnym/regionalnym. Stosowanie produktu powinno być zgodne z oficjalną, krajową i regionalną polityką przeciwdrobnoustrojową. Stosowanie produktu niezgodnie z zaleceniami podanymi w ChPLW może zwiększać występowanie bakterii opornych na doksycyklinę i zmniejszać skuteczność leczenia innymi tetracyklinami z powodu potencjalnej oporności krzyżowej.
Ponieważ tabletki są aromatyzowane, należy przechowywać je poza zasięgiem zwierząt, aby uniknąć przypadkowego połknięcia.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Tetracykliny mogą powodować reakcje nadwrażliwości (alergiczne).
Osoby o znanej nadwrażliwości na tetracykliny powinny unikać kontaktu z produktem leczniczym
weterynaryjnym.
W przypadku wystąpienia objawów po ekspozycji, takich jak wysypka skórna, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną.
Doksycyklina może powodować zaburzenia żołądkowo-jelitowe po przypadkowym połknięciu, zwłaszcza przez dzieci. W celu uniknięcia przypadkowego połknięcia, zwłaszcza przez dziecko, niezużyte części tabletki należy włożyć z powrotem do otwartego blistra i do pudełka tekturowego. Po przypadkowym połknięciu, zwłaszcza przez dzieci, należy zwrócić się o pomoc lekarską.
Umyć ręce po użyciu.
Zaburzenia żołądkowo-jelitowe, takie jak wymioty, biegunka i zapalenie przełyku, zgłaszano bardzo rzadko jako działania niepożądane po leczeniu doksycykliną.
U bardzo młodych zwierząt przebarwienie zębów w skutek tworzenia się kompleksu tetracyklina- fosforan wapnia może wystąpić bardzo rzadko. Reakcje nadwrażliwości, wrażliwość na światło i, w wyjątkowych przypadkach, fotodermatoza mogą bardzo rzadko wystąpić po ekspozycji na intensywne światło dzienne.
Wiadomo, że w przypadku stosowania innych tetracyklin bardzo rzadko występuje opóźnienie rozwoju kośćca młodych zwierząt (odwracalne po zakończeniu leczenia) i może ono wystąpić po podaniu doksycykliny.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego w czasie ciąży i laktacji nie zostało określone. Tetracykliny mogą opóźniać rozwój kośćca u płodu (w pełni odwracalne) i powodować przebarwienie zębów mlecznych. Dowody z piśmiennictwa dotyczącego ludzi sugerują jednak, że w przypadku doksycykliny istnieje mniejsze prawdopodobieństwo spowodowania tych nieprawidłowości niż w przypadku innych tetracyklin. Do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Nie podawać jednocześnie z antybiotykami bakteriobójczymi, takimi jak penicyliny i cefalosporyny. Doustnych substancji pochłaniających i substancji zawierających kationy wielowartościowe, takich jak leki zobojętniające kwas żołądkowy i sole żelaza, nie należy stosować na 3 godziny przed, do 3 godzin po podaniu doksycykliny. Okres półtrwania doksycykliny ulega skróceniu wskutek jednoczesnego podawania leków przeciwpadaczkowych, takich jak fenobarbital i fenytoina.
Podanie doustne.
Zalecana dawka dla psów i kotów to 10 mg doksycykliny na kg masy ciała na dobę. W większości rutynowych przypadków oczekuje się odpowiedzi na leczenie po 5-7 dniach leczenia. Leczenie należy kontynuować przez 2-3 dni po uzyskaniu klinicznego wyleczenia w przypadku ostrych zakażeń. W przypadku chorób przewlekłych lub nawracających może być wymagany dłuższy, do 14 dni, czas trwania leczenia. U psów ze śródmiąższowym zapaleniem nerek z powodu leptospirozy zaleca się leczenie przez 14 dni. U kotów z zakażeniami wywołanymi przez C. felis zaleca się leczenie przez minimum 28 dni w celu zapewnienia eliminacji patogenu z organizmu. W celu zapewnienia prawidłowego dawkowania należy jak najdokładniej ustalić masę ciała, aby uniknąć podawania za małych dawek. Tabletki należy podawać razem z pożywieniem (patrz punkt 4.5).
Poniższa tabela służy jako wskazówka dotycząca podawania produktu w standardowej dawce 10 mg
na kg masy ciała na dobę.
Masa ciała | Dawka mg | Doxybactin 50 mg | Doxybactin 200 mg | Doxybactin 400 mg | ||
0,75 kg-1,25 kg | 12,5 |
| - | - | ||
>1,25 kg-2,5 kg | 25 |
| - | - | ||
>2,5 kg-3,75 kg | 37,5 |
| - | - | ||
>3,75 kg-5 kg | 50 |
| - | - | ||
>5 kg-6,25 kg | 62,5 |
| - | - | ||
>6,25 kg-7,5 kg | 75 |
| - | - | ||
>7,5 kg-10 kg | 100 |
| - | - | ||
>10 kg-12,5 kg | 125 |
| - | - | ||
>12,5 kg-15 kg | 150 |
| - | |||
>15 kg-20 kg | 200 | - |
| - | ||
>20 kg-25 kg | 250 |
| oraz |
| - | |
>25 kg-30 kg | 300 | - |
| - | ||
>30 kg-35 kg | 350 | - |
| - |
>35 kg-40 kg | 400 | - | - |
| ||
>40 kg-45 kg | 450 |
| oraz |
| ||
>45 kg-50 kg | 500 | - |
| oraz |
| |
>50 kg-60 kg | 600 | - |
| oraz |
| |
>60 kg-70 kg | 700 | - |
| oraz |
| |
>70 kg-80 kg | 800 | - | - |
| ||

= ¼ tabletki  = ½ tabletki
= ½ tabletki  = ¾ tabletki
= ¾ tabletki  = 1 tabletka
= 1 tabletka
Tabletki można dzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania. Tabletkę umieścić na płaskiej powierzchni ze stroną z linią podziału skierowaną do góry i stroną wypukłą (zaokrągloną) skierowaną do powierzchni.
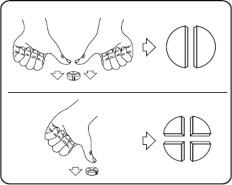
2 równe części: nacisnąć kciukami po obu stronach tabletki. 4 równe części: nacisnąć kciukiem po środku tabletki.
W przypadku przedawkowania nie są spodziewane inne objawy niż te, wymienione w punkcie 4.6.
Nie dotyczy.
Grupa farmakoterapeutyczna: leki przeciwbakteryjne do stosowania ogólnego, tetracykliny. Kod ATCvet: QJ01AA02.
Doksycyklina jest antybiotykiem o szerokim spektrum działania należącym do klasy tetracyklin, działającym przeciwko dużej liczbie bakterii Gram-dodatnich i Gram-ujemnych, w tym gatunkom tlenowym i beztlenowym.
Doksycyklina hamuje syntezę białek bakteryjnych poprzez wiązanie się z podjednostkami 30-S rybosomów. Zaburza to wiązanie aminoacetylo-tRNA z miejscem akceptorowym na kompleksie rybosomów mRNA i zapobiega sprzęganiu aminokwasów z wydłużającymi się łańcuchami peptydowymi; doksycyklina ma głównie działanie bakteriostatyczne.
Przenikanie doksycykliny do komórki bakteryjnej odbywa się zarówno poprzez transport aktywny, jak i dyfuzję bierną.
Główne mechanizmy nabytej oporności na antybiotyki z grupy tetracyklin obejmują aktywny wypływ i ochronę rybosomów. Trzeci mechanizm to degradacja enzymatyczna. Geny pośredniczące w oporności mogą być przenoszone na plazmidy lub transpozony, jak na przykład tet(M), tet(O) i tet(B), które można znaleźć zarówno w organizmach Gram-dodatnich, jak i Gram-ujemnych, w tym w izolatach klinicznych.
Oporność krzyżowa na inne tetracykliny jest powszechna, ale zależy od mechanizmu oporności. Ze względu na większą rozpuszczalność w tłuszczach i większą zdolność przechodzenia przez błony komórkowe (w porównaniu z tetracykliną), doksycyklina zachowuje pewien stopień skuteczności wobec mikroorganizmów z nabytą opornością na tetracykliny poprzez pompy efflux. Jednak oporność, w której pośredniczą białka ochronne rybosomów, nadaje oporność krzyżową na doksycyklinę.
Po podaniu doustnym doksycyklina wchłania się głównie z dwunastnicy i jelita czczego.
Biodostępność po podaniu doustnym wynosi >50%.
Doksycyklina ulega swobodnej dystrybucji w organizmie i może gromadzić się wewnątrzkomórkowo np. w leukocytach. Odkłada się w aktywnej tkance kostnej i zębach. Doksycyklina jest wydalana głównie z kałem poprzez bezpośrednie wydalanie jelitowe i w mniejszym stopniu poprzez wydalanie kłębuszkowe oraz wydalanie z żółcią.
Glikolan sodowy skrobi (typ A) Krzemionka koloidalna bezwodna Celuloza mikrokrystaliczna Drożdże (suszone)
Aromat kurczaka Magnezu stearynian
Nie dotyczy
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 30 miesięcy. Okres ważności tabletek podzielonych: 3 dni.
6.4. Specjalne środki ostrożności podczas przechowywania
Przechowywać w temperaturze poniżej 30°C.
Blister Aluminium - PCV/PE/PVDC.
Pudełko tekturowe zawierające 1, 2, 3 lub 10 blistrów po 10 tabletek.
Pudełko tekturowe zawierające 10 oddzielnych pudełek tekturowych, zawierających po 1 blistrze po 10 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Le Vet Beheer B.V. Wilgenweg 7
3421 TV Oudewater
Holandia
2748/18
/DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 12.03.2018 Data przedłużenia pozwolenia:
29.11.2022.
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB
STOSOWANIA
Nie dotyczy.