Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Zakażenia dróg oddechowych, szczególnie odoskrzelowe zapalenie płuc, wywołane przez
Staphylococcus aureus, Streptococcus spp., Escherichia coli i Klebsiella spp.
Zakażenia dróg moczowych wywołane przez Escherichia coli, Proteus spp. i Staphylococcus
spp.
Zakażenia skóry wywołane przez Staphylococcus spp.
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1 ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1 ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1 ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w okresie ciąży i laktacji
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Cefabactin 500 mg tabletki dla psów
Cefabactin 500 mg tablets for dogs (AT, BE, CY, CZ, EL, ES, FR, HR, HU, IE, IT, LU, NL, PT, RO, SI, SK, UK)
Cefatab flavour 500 mg tablets for dogs (DE)
Cefabactin vet 500 mg tablets for dogs (DK, FI, IS, NO, SE, EE, LT, LV)
Każda tabletka zawiera:
Substancja czynna:
Cefaleksyna (jako cefaleksyna jednowodna) 500 mg
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Tabletka
Jasnobrązowa z brązowymi plamkami, okrągła i wypukła tabletka aromatyzowana z liniami podziału w kształcie krzyża po jednej stronie.
Tabletki mogą być podzielone na 2 lub 4 równe części.
Psy.
Do leczenia następujących zakażeń:
Nie stosować w przypadku nadwrażliwości na substancję czynną, na inne cefalosporyny, na inne
substancje z grupy β-laktamów lub na dowolną substancję pomocniczą.
Nie stosować w przypadku stwierdzonej oporności na cefalosporyny lub penicyliny. Nie stosować u królików, świnek morskich, chomików i myszoskoczków.
Brak.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Ze względu na prawdopodobną zmienność (w czasie, geograficzną) występowania oporności bakterii
na cefaleksynę zaleca się pobranie próbek bakteriologicznych i zbadanie lekowrażliwości.
Produkt należy stosować wyłącznie w oparciu o wynik badania lekowrażliwości bakterii wyizolowanych od zwierzęcia. Jeśli nie jest to możliwe, leczenie należy prowadzić w oparciu o lokalne informacje epidemiologiczne.
Podczas stosowania leczniczego weterynaryjnego należy uwzględniać oficjalne krajowe i regionalne zalecenia dotyczące stosowania substancji przeciwdrobnoustrojowych.
Stosowanie produktu niezgodnie z zaleceniami zawartymi w ChPLW może skutkować zwiększeniem częstości występowania oporności bakterii na cefaleksynę i zmniejszeniem skuteczności leczenia innymi antybiotykami beta-laktamowymi ze względu na możliwość wystąpienia oporności krzyżowej.
W przypadku przewlekłej niewydolności nerek należy obniżyć dawkę lub wydłużyć odstęp między
kolejnymi podaniami.
Tabletki są aromatyzowane. Aby nie dopuścić do przypadkowego połknięcia, tabletki należy przechowywać w miejscu niedostępnym dla zwierząt.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Penicyliny i cefalosporyny mogą wywoływać nadwrażliwość (alergię) po wstrzyknięciu, inhalacji, spożyciu lub kontakcie ze skórą. Nadwrażliwość na penicyliny może prowadzić do nadwrażliwości krzyżowej na cefalosporyny i odwrotnie. Reakcje alergiczne na te substancje sporadycznie mogą być ciężkie. Z produktem leczniczym weterynaryjnym nie powinny mieć bezpośredniej styczności osoby, u których stwierdzono uczulenie lub którym zalecono, by nie miały styczności z tego rodzaju substancjami.
Należy zachować środki ostrożności podczas podawania produktu, aby nie dopuścić do narażenia.
W przypadku pojawienia się objawów po ekspozycji na produkt, takich jak wysypka skórna, należy zwrócić się o pomoc lekarską oraz pokazać lekarzowi to ostrzeżenie. Obrzęk twarzy, warg lub powiek bądź trudności z oddychaniem są poważniejszymi objawami i wymagają natychmiastowej pomocy lekarskiej.
Aby uniknąć przypadkowego połknięcia przez dziecko należy włożyć podzielone lub niezużyte
tabletki z powrotem do otwartego blistra i umieścić z powrotem w opakowaniu zewnętrznym.
Po przypadkowym połknięciu należy niezwłocznie zwrócić się o pomoc lekarską oraz pokazać lekarzowi ulotkę informacyjną lub opakowanie.
Po podaniu umyć ręce.
U psów leczonych produktami zawierającymi cefaleksynę sporadycznie obserwowano wymioty. Podobnie jak przy podawaniu innych antybiotyków, może wystąpić biegunka. W przypadku nawracających wymiotów i(lub) nawracającej biegunki podawanie produktu należy przerwać, a następnie zwrócić się o poradę do prowadzącego lekarza weterynarii. Bardzo rzadko może wystąpić ospałość.
Rzadko może dochodzić do reakcji nadwrażliwości. W przypadku wystąpienia reakcji nadwrażliwości należy przerwać leczenie.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Badania laboratoryjne u szczurów i myszy nie wykazały działania teratogennego.
Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego u psów w czasie ciąży i laktacji nie zostało określone. Do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
W celu zapewnienia skuteczności leczenia, nie należy stosować produktu leczniczego weterznaryjnego w z antybiotykami bakteriostatycznymi (makrolidy, sulfonamidy i tetracykliny). Jednoczesne stosowanie cefalosporyn pierwszej generacji z antybiotykami aminoglikozydowymi lub niektórymi lekami moczopędnymi, np. furosemidem, może zwiększać ryzyko nefrotoksyczności.
Podanie doustne
Dawka zalecana wynosi 15–30 mg cefaleksyny na kg masy ciała dwa razy na dzień przez co najmniej 5 kolejnych dni. Prowadzący lekarz weterynarii może wydłużyć okres stosowania produktu w przypadku np. zakażeń dróg moczowych lub bakteryjnego zapalenia skóry.
W celu zapewnienia prawidłowego dawkowania, aby uniknąć podawania zbyt niskiej dawki należy jak najdokładniej ustalić masę ciała.
Poniższą tabelę przygotowano jako instrukcję podawania produktu w dawce wynoszącej 15 mg cefaleksyny na kg masy ciała dwa razy na dobę
PODAWANIE DWA RAZY NA DOBĘ | |||||
Masa ciała | Dawka w mg | Cefabactin 50 mg | Cefabactin 250 mg | Cefabactin 500 mg | Cefabactin 1000 mg |
>0,5 kg – 0,8 kg | 12,5 |
| - | - | - |
>0,8 kg – 1,6 kg | 25 |
| - | - | - |
>1,6 kg – 2,5 kg | 37,5 |
| - | - | - |
>2,5 kg – 3,3 kg | 50 |
| - | - | - |
>3,3 kg – 5 kg | 75 |
| - | - | - |
>5 kg – 6,6 kg | 100 |
| - | - | - |
>6,6 kg – 8 kg | 125 |
|
| - | |
>8 kg – 10 kg | 150 |
| - | - | - |
>10 kg – 12,5 kg | 188 | - |
| - | - |
>12,5 kg – 16,6 kg | 250 | - |
|
| - |
>16,6 kg – 20 kg | 313 |
| |||
>20 kg – 25 kg | 375 | - |
| - | |
>25 kg – 29 kg | 438 | - |
| - |
>29 kg – 33 kg | 500 | - |
|
|
>33 kg – 41 kg | 625 | - | - | - |
>41 kg – 50 kg | 750 | - | - |
|
>50 kg – 58 kg | 875 | - | - | - |
>58 kg – 66 kg | 1000 | - | - |
|
>66 kg – 83 kg | 1250 | - | - - |
|









= ¼ tabletki = ½ tabletki = ¾ tabletki = 1 tabletka
Tabletkę można podzielić na 2 lub 4 równe części, aby zapewnić dokładne dawkowanie. Położyć tabletkę na płaskiej powierzchni nacięciem do góry.
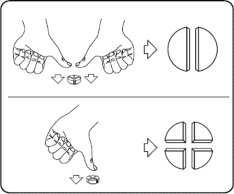
Połówki: docisnąć kciukami obie strony tabletki. Ćwiartki: nacisnąć kciukiem środek tabletki.
Działania niepożądane, inne niż te wymienione w punkcie 4.6., nie są znane. W przypadku przedawkowania należy zastosować leczenie objawowe.
Nie dotyczy.
Grupa farmakoterapeutyczna: leki przeciwbakteryjne do stosowania ogólnego, cefalosporyny pierwszej generacji.
Kod ATCvet: QJ01DB01
Mechanizm działania cefalosporyn przypomina mechanizm działania penicylin, szczególnie ampicyliny (wspólny pierścień beta-laktamowy). Cefalosporyny wykazują zależne od czasu działanie bakteriobójcze na dzielące się bakterie. Wiążą się one nieodwracalnie z białkami wiążącymi penicyliny (penicillin-binding proteins – PBP), czyli enzymami koniecznymi do wytworzenia wiązań krzyżowych między poszczególnymi łańcuchami peptydoglikanowymi w trakcie biosyntezy bakteryjnej ściany komórkowej. Dochodzi do zaburzenia procesu sieciowania łańcuchów
peptydoglikanowych odpowiadającego za nadawanie komórce bakteryjnej wytrzymałości
i sztywności. Powoduje to nieprawidłowy wzrost komórek oraz ich lizę.
Cefaleksyna wykazuje aktywność wobec bakterii Gram-dodatnich oraz niektórych bakterii Gram- ujemnych.
Opublikowane przez CLSI weterynaryjne progi wrażliwości dla cefalotyny (CLSI VET01S wyd. 5, listopad 2020) są następujące:
Cefalotynę można stosować jako substancję wskaźnikową dla cefalosporyn pierwszej generacji. Zakażenia skóry i tkanek miękkich:
Gatunek bakterii Wrażliwość Oporność
Staphylococcus aureus
i Staphylococcus pseudintermedius ≤2 μg/ml ≥4 μg/ml
Streptococcus spp i E. coli ≤2 μg/ml ≥8 μg/ml
Zakażenia układu moczowego:
Gatunek bakterii Wrażliwość Oporność
E. coli, Klebsiella pneumoniae
i Proteus mirabilis ≤16 μg/ml ≥32 μg/ml
Oporność na cefaleksynę, podobnie jak w przypadku penicylin, może wynikać z jednego
z mechanizmów lekooporności, polegającym na wytwarzaniu różnorodnych beta-laktamaz, które mogą być kodowane na plazmidach lub w chromosomach, a także wskutek mutacji wieloetapowych. W pierwszym przypadku prawie zawsze towarzyszy temu oporność krzyżowa na ampicylinę, natomiast w pozostałych przypadkach stwierdza się częściową lub całkowitą oporność krzyżową na wszystkie penicyliny i cefalosporyny. Wszystkie gronkowce metycylinooporne są jednocześnie oporne na cefalosporyny.
Po podaniu cefaleksyna jednowodna jest szybko i prawie całkowicie wchłaniana z przewodu pokarmowego. Obecność treści pokarmowej spowalnia wchłanianie (niższe stężenia leku we krwi). Stopień wiązania z białkami surowicy wynosi około 20%.
Po jednorazowym podaniu doustnym dawki 20 mg cefaleksyny na kg masy ciała u psów uzyskano Tmax wynoszący około 1–1,5 h, Cmax w osoczu wynoszące około 15 µg/ml oraz okres półtrwania
w fazie eliminacji wynoszący około 2 h (biodostępność wyniosła 75–80%). Objętość dystrybucji
wynosi 1,62 l/kg.
Po wchłonięciu cefaleksyna jest dobrze dystrzbuowana w płynie pozakomórkowym, natomiast jej
przenikanie przez błony biologiczne jest ograniczone. Cefaleksyna osiąga najwyższe stężenia
w nerkach (mocz) i żółci, a niższe w wątrobie, płucach, sercu, mięśniach szkieletowych i śledzionie. Cefaleksyna jest w znikomym stopniu metabolizowana w wątrobie. Eliminacja odbywa się głównie przez nerki drogą sekrecji kanalikowej i filtracji kłębuszkowej. Cefaleksyna jest też wydzielana do żółci, gdzie osiąga takie samo stężenie jak we krwi lub nieco wyższe.
Laktoza jednowodna Skrobia ziemniaczana
Krzemionka koloidalna bezwodna
Drożdże (suszone)
Aromat drobiowy
Magnezu stearynian
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata.
Okres ważności po pierwszym otwarciu opakowania bezpośredniego dla podzielonych tabletek: 4 dni.
Nie przechowywać w temperaturze powyżej 25°C.
Blister z folii aluminium-PVC/PE/PVDC.
Pudełko tekturowe zawierające 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 lub 25 blistrów po 10 tabletek.
Pudełko tekturowe zawierające 10 oddzielnych pudełek tekturowych, każde zawierające 1 blister po 10 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Le Vet. Beheer BV Wilgenweg 7
3421 TV Oudewater Holandia
2770/18
OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 20.04.2018 r. Data przedłużenia pozwolenia:
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB
STOSOWANIA
Nie dotyczy.


































