Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres (-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Canicaral vet 160 mg tabletki dla psów
Canicaral vet 160 mg tablets for dogs (DK, FI, IS, NO, SE, EE, LT, LV)
Carporal160 mg tablets for dogs
(AT, BE, CY, CZ, EL, ES, FR, HR, HU, IE, IT, LU, NL, PT, RO, SI, SK, UK)
Każda tabletka zawiera:
Substancja czynna:
Karprofen 160 mg
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Tabletka.
Jasnobrązowa z brązowymi kropkami, okrągła i wypukła, aromatyzowana tabletka z linią podziału w kształcie krzyża z jednej strony.
Tabletki można podzielić na 2 lub 4 równe części.
Psy.
Zmniejszenie stanu zapalnego i bólu spowodowanego zaburzeniami mięśniowo-szkieletowymi i zwyrodnieniową chorobą stawów. Jako uzupełnienie leczenia bólu pooperacyjnego po
wcześniejszym leczeniu przeciwbólowym z zastosowaniem produktu przeznaczonego do podawania
pozajelitowego.
Nie stosować u kotów.
Nie stosować u suk w ciąży lub w okresie laktacji.
Nie stosować u psów w wieku poniżej 4. miesiąca życia.
Nie stosować w znanych przypadkach nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
Nie stosować u zwierząt z chorobą serca, wątroby lub nerek, u których istnieje możliwość występowania owrzodzenia przewodu pokarmowego lub krwawienia z przewodu pokarmowego lub u których stwierdzono dyskrazję krwi.
Patrz punkty 4.3 i 4.5.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Stosowanie u starszych psów może być związane z wystąpieniem dodatkowego ryzyka.
Jeśli nie można uniknąć zastosowania tego leku, psy mogą wymagać starannego postępowania
klinicznego.
Unikać stosowania u psów odwodnionych, u których występuje hipowolemia lub niedociśnienie krwi, ze względu na potencjalne ryzyko wystąpienia zwiększenia toksyczności dla nerek.
Niesteroidowe leki przeciwzapalne (NLPZ) mogą spowodować zahamowanie fagocytozy i dlatego w leczeniu stanów zapalnych związanych z zakażeniem bakteryjnym należy jednocześnie wdrożyć odpowiednie leczenie przeciwbakteryjne.
Tabletki są aromatyzowane. Aby uniknąć przypadkowego spożycia, tabletki należy przechowywać poza zasięgiem zwierząt.
Patrz punkt 4.8.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Po przypadkowym połknięciu tabletek należy zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie. Umyć ręce po posługiwaniu się produktem.
Bardzo rzadko zgłaszano typowe działania niepożądane związane z NLPZ, takie jak wymioty, luźne stolce i (lub) biegunka, obecność krwi utajonej w kale, utrata łaknienia i apatia. Takie działania niepożądane występują zazwyczaj w pierwszym tygodniu leczenia i w większości przypadków mają charakter przejściowy i ustępują po zakończeniu leczenia, ale w bardzo rzadkich przypadkach mogą być poważne lub prowadzić do zgonu.
W przypadku wystąpienia działań niepożądanych należy przerwać stosowanie produktu i zasięgnąć
porady lekarza weterynarii.
Jak w przypadku innych NLPZ, istnieje ryzyko rzadkich działań niepożądanych ze strony nerek lub
działań niepożądanych dotyczących wątroby a związanych z idiosynkrazją.
Częstość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Badania przeprowadzone na zwierzętach laboratoryjnych (szczury i króliki) wykazały toksyczne działanie karprofenu dla płodu w dawkach zbliżonych do dawki terapeutycznej. Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego w czasie ciąży i laktacji nie zostało określone.
Patrz punkt 4.3.
Nie należy podawać innych NLPZ ani glikokortykosteroidów jednocześnie lub w ciągu 24 godzin od podania produktu. Karprofen wiąże się w wysokim stopniu z białkami osocza i może konkurować z innymi lekami wiązanymi w wysokim stopniu, co może prowadzić do wystąpienia działania toksycznego.
Należy unikać jednoczesnego podawania potencjalnie nefrotoksycznych leków.
Podanie doustne.
W celu zapewnienia prawidłowego dawkowania należy jak najdokładniej ustalić masę ciała, aby uniknąć przedawkowania.
Dawkowanie
Od 2 do 4mg karprofenu na kg masy ciała na dobę.
W celu zmniejszenie stanu zapalnego i bólu spowodowanego występowaniem zaburzeń
mięśniowo-szkieletowych i zwyrodnieniową chorobą stawów: dawkę początkową 4 mg karprofenu na kg masy ciała na dobę, podawane jako pojedyncza dawka dobowa lub w dwóch równo podzielonych dawkach, można zmniejszyć w zależności od odpowiedzi klinicznej do 2 mg karprofenu/kg masy ciała/dobę, podawanych jako dawka pojedyncza. Czas trwania leczenia zależy od reakcji obserwowanej u pacjenta. W przypadku leczenia trwającego dłużej niż 14 dni pies musi być regularnie badany przez lekarza weterynarii.
Nie należy przekraczać zalecanego dawkowania.
W celu rozszerzenia działania przeciwbólowego i przeciwzapalnego w okresie pooperacyjnym, po przedoperacyjnym leczeniu produktem zawierającym karprofen do wstrzykiwań, można zastosować karprofen w postaci tabletek w dawce 4 mg/kg m.c./dobę przez okres do 5dni.
Poniższa tabela służy jako wskazówka odnośnie podawania produktu w dawce 4 mg na kg masy ciała na dobę.
Liczba tabletek w dawce 4 mg/kg m.c. | ||||||
Masa ciała (kg) | Canicaralvet 40 mg Raz na dobę | Canicaral 40 mg vet Dwa razy na dobę | Canicaralvet 160 mg Raz na dobę | Canicaralvet 160 mg Dwa razy na dobę | ||
>2,5 kg-5 kg |
| |||||
>5 kg-7,5 kg |
|
|
| |||
>7,5 kg-10 kg |
|
|
| |||
>10 kg-12,5 kg |
|
|
| |||
>12,5 kg-15 kg |
|
|
| |||
>15 kg-17,5 kg |
|
|
| |||
>17,5 kg-20 kg |
|
|
| |||
>20 kg-25 kg |
|
|
|
|
|
|
>25 kg-30 kg |
|
|
| |||
>30 kg-35 kg |
|
|
|
|
|
|
>35 kg-40 kg |
|
|
| |||
>40 kg-50 kg |
|
|
|
|
|
|
>50 kg-60 kg |
|
|
| |||
>60 kg-70 kg |
|
|
| |||
>70 kg-80 kg |
|
|
|




= ¼ tabletki = ½ tabletki = ¾ tabletki = 1 tabletka
Tabletki można dzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania. Tabletkę umieścić na płaskiej powierzchni ze stroną z linią podziału skierowaną do góry i stroną wypukłą (zaokrągloną) skierowaną do powierzchni.
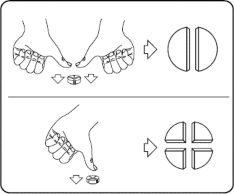
Połówki: nacisnąć kciukami po obu stronach tabletki. Ćwiartki: nacisnąć kciukiem w połowie tabletki.
Objawy toksyczności nie występowały podczas leczenia psów karprofenem w dawkach do 6 mg/kg
m.c. dwa razy na dobę przez 7 dni (3-krotność najwyższej zalecanej dawki 4 mg/kg m.c.) i 6 mg/kg
m.c. raz na dobę przez kolejne 7 dni (1,5-krotność najwyższej zalecanej dawki 4 mg/kg m.c.).
Brak specyficznej odtrutki przy przedawkowanie karprofenu, ale należy zastosować ogólną terapię
wspomagającą, stosowaną w przypadku przedawkowania NLPZ.
Nie dotyczy.
Grupa farmakoterapeutyczna: Leki przeciwzapalne i przeciwreumatyczne, niesteroidowe. Pochodne kwasu propionowego, karprofen.
Kod ATCvet: QM01AE91
5.1. Właściwości farmakodynamiczne
Karprofen jest niesteroidowym lekiem przeciwzapalnym (NLPZ). Jest pochodną kwasu fenylopropionowego i należy do klasy kwasów 2-arylopropionowych NLPZ. Zawiera centrum chiralne w C2 części propionowej i dlatego występuje w dwóch postaciach stereoizomerycznych, enancjomerach S (+) i R (-). U psów nie występuje inwersja chiralna między enancjomerami in vivo.
Karprofen wykazuje działanie przeciwzapalne, przeciwbólowe i przeciwgorączkowe. Podobnie jak większość innych NLPZ, karprofen jest inhibitorem enzymu cyklooksygenazy, uczestniczącego w cyklu przemian kwasu arachidonowego.
Jednak hamowanie syntezy prostaglandyn przez karprofen jest nieznaczne w porównaniu do jego działania przeciwzapalnego i przeciwbólowego. Dokładny mechanizm działania karprofenu nie jest wyjaśniony.
5.2 Właściwości farmakokinetyczne
Po podaniu doustnym psom wchłanianie karprofenu jest szybkie (Tmax=2,0 godz.). Cmax wynosi 28,67µg/ml. Objętość dystrybucji jest mała i karprofen silnie wiąże się z białkami osocza. Metabolizm karprofenu odbywa się w wątrobie, gdzie tworzy się ester glukuronid i dwa diastereoizomery 1-O- acylo-β-D-glukuronidu. Są one wydalane do dróg żółciowych i wydalane z kałem.
Laktoza jednowodna Karboksymetyloskrobia sodowa (typ A) Skrobia kukurydziana
Talk
Celuloza, proszek
Skrobia żelatynowa
Krzemionka, koloidalna bezwodna Wapnia behenian
Drożdże dezaktywowane
Sztuczny aromat wołowiny
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 3 lata.
Podzieloną tabletkę należy zużyć w ciągu 3 dni.
Niezużyte części tabletek należy włożyć z powrotem do otwartego blistra w celu ochrony przed światłem.
Brak specjalnych środków ostrożności dotyczących przechowywania nieotwartego blistra.
Blister Aluminium/PA/ALU/PVC
Pudełko tekturowe zawierające 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 25 lub 50 blistrów po 10 tabletek Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z
obowiązującymi przepisami lokalnymi/krajowymi.
Le Vet. Beheer B.V. Wilgenweg 7
3421 TV Oudewater
Holandia
2933/19
OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 10/10/2019 Data przedłużenia pozwolenia:
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB
STOSOWANIA
Nie dotyczy.



































































