Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstość i stopień nasilenia)
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
Clearonil 50 mg roztwór do nakrapiania dla kotów
Bob Martin Clear Spot On Solution 50 mg for Cats [UK]
Bob Martin Clear Fipronil 50 mg solution spot on for cats [ES] Bob Martin Vetcare Spot On Fipronil solution 50 mg for cats [FR] Fipronil Bob Martin Spot-on Solution 50 mg for cats [IT] Kruidvat Flea Drops 50 mg solution for cats [NL]
Jedna pipetka o pojemności 0,5 ml zawiera:
Substancja czynna:
Fipronil 50,00 mg
Substancje pomocnicze:
Butylohydroksyanizol (E320) 0,10 mg
Butylohydroksytoluen (E321) 0,05 mg Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Roztwór do nakrapiania
Klarowny, bladobursztynowy roztwór
Koty
Leczenie inwazji pcheł (Ctenocephalides felis). Produkt zachowuje skuteczność owadobójczą przez okres do 5 tygodni w przypadku pcheł (Ctenocephalides felis).
Produkt wykazuje skuteczność roztoczobójczą w przypadku inwazji kleszczy z gatunku Dermacentor reticulatus po upływie tygodnia od podania; niemniej nie obserwowano skuteczności roztoczobójczej bezpośrednio po zastosowaniu leczenia oraz po upływie dwóch tygodni od leczenia. Jeśli w momencie zastosowania produktu na ciele zwierzęcia obecne są kleszcze tego gatunku, jest możliwe, że nie wszystkie zginą w przeciągu pierwszych 48 godzin, natomiast wszystkie osobniki zostaną wyeliminowane w ciągu tygodnia.
Nie stosować u kociąt poniżej 2. miesiąca życia i (lub) o masie ciała poniżej 1 kg.
Nie stosować u zwierząt w złym stanie zdrowia, zwierząt leczonych lub wracających do zdrowia po okresie choroby.

Nie stosować u królików! Stosowanie produktu może spowodować działania niepożądane, a nawet śmierć.
Nie stosować w przypadku nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
W okresie spodziewanego skutecznego działania produktu (tj. po upływie jednego tygodnia) kleszcze są eliminowane i odpadają od żywiciela w ciągu 48 godzin od inwazji, przy czym zazwyczaj nie dochodzi do odżywiania się krwią żywiciela. Ponieważ po zastosowaniu leczenia może dojść do przyczepiania się pojedynczych osobników, nie można wykluczyć transmisji chorób zakaźnych przenoszonych przez kleszcze. W większości przypadków martwy kleszcz samoistnie odpadnie od skóry żywiciela, niemniej pozostałe kleszcze można łatwo usunąć za pomocą delikatnego pociągnięcia.
Pchły często przedostają się ze zwierzęcia do jego koszyka, na wyściółkę legowiska lub stałe miejsca odpoczynku na dywanach lub tapicerowanych meblach, stąd w przypadku znacznej inwazji pcheł miejsca te powinny zostać poddane działaniu odpowiedniego środka owadobójczego w momencie rozpoczęcia leczenia, a następnie być regularnie odkurzane.
Nie dopuszczać, by zwierzę często pływało i unikać częstego kąpania zwierzęcia z użyciem szamponu, ponieważ zachowanie skuteczności produktu w takich przypadkach nie było badane.
Optymalne przeciwdziałanie w przypadku obecności pcheł w gospodarstwie domowym z większą liczbą zwierząt domowych powinno polegać na zastosowaniu odpowiedniego środka owadobójczego wobec wszystkich psów i kotów w gospodarstwie domowym.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Unikać kontaktu z oczami zwierzęcia. W razie przypadkowego dostania się produktu do oka, należy niezwłocznie i dokładnie przemyć je wodą.
Nie stosować produktu na rany lub uszkodzoną skórę.
Ważne jest, aby produkt został podany w miejscu, z którego zwierzę nie może go zlizać. Należy również zapobiec wzajemnemu wylizywaniu się zwierząt po leczeniu.
Bezpieczeństwo tego produktu nie było przedmiotem badań, w których doprowadzano do przedawkowania lub w których stosowano podania wielokrotne z uwagi na fakt, że profil bezpieczeństwa substancji czynnej i pozostałych substancji pomocniczych został już dobrze poznany.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Ten produkt leczniczy weterynaryjny może powodować podrażnienie błon śluzowych i oczu. Stąd też należy unikać kontaktu z ustami lub oczami.
W razie przypadkowego kontaktu z oczami należy niezwłocznie i dokładnie przemyć oczy wodą. Jeśli podrażnienie oka utrzymuje się, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Unikać kontaktu zawartości z palcami. Jeśli dojdzie do takiego kontaktu, należy umyć ręce wodą z mydłem. Umyć ręce po użyciu produktu.
W trakcie stosowania produktu nie wolno palić, pić ani spożywać pokarmów.
Osoby o znanej nadwrażliwości na fipronil lub jakiekolwiek składniki produktu powinny unikać kontaktu z produktem leczniczym weterynaryjnym. Bezpośredni kontakt ze zwierzętami nie jest wskazany zanim miejsce podania produktu nie wyschnie. Nie należy zezwalać dzieciom na zabawę z leczonymi zwierzętami do momentu wyschnięcia miejsca podania. Zaleca się zatem, aby nie stosować
produktu w ciągu dnia, ale dokonać podania wczesnym wieczorem. Wkrótce po zabiegu zwierzęta nie powinny spać z właścicielami, w szczególności z dziećmi.
Inne środki ostrożności
Produkt może uszkodzić malowane, lakierowane lub innego rodzaju wykończone powierzchnie lub wyposażenie gospodarstwa domowego.
Jeżeli dojdzie do wylizywania miejsca podania, może pojawić się krótkotrwałe, intensywne ślinienie, które spowodowane będzie głównie rozpuszczalnikami zawartymi w produkcie.
Wśród bardzo rzadkich, spodziewanych działań niepożądanych zgłaszano przejściowe odczyny skórne w miejscu zastosowania (łuszczenie się skóry, miejscowa utrata sierści, podrażnienie skóry, swędzenie i zaczerwienienie) oraz uogólnione podrażnienie skóry lub utratę sierści. W rzadkich przypadkach, po zastosowaniu obserwowano nadmierne ślinienie się oraz odwracalne objawy z układu nerwowego (np. pobudliwość, przygnębienie) lub wymioty.
Badania laboratoryjne z zastosowaniem fipronilu nie wykazały jakiegokolwiek działania teratogennego czy embriotoksycznego. Bezpieczeństwo produktu nie zostało wykazane u kotek w rui, ciąży i laktacji. Produkt może być stosowany w trakcie ciąży i laktacji jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Nieznane
Podanie przez nakrapianie. Wyłącznie do użytku zewnętrznego.
Stosować miejscowo na skórę używając 1 pipetki o pojemności 0,5 ml na zwierzę.
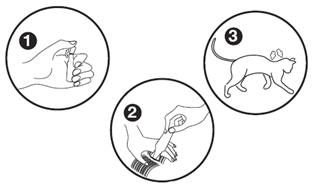
Wyjąć pipetkę z blistra. Pipetkę trzymać w pozycji pionowej i odłamać górną część zatyczki, tym samym otwierając pipetkę.
Rozdzielić palcami sierść, aby odsłonić skórę zwierzęcia. Przyłożyć końcówkę pipetki bezpośrednio do odsłoniętej skóry i delikatnie ścisnąć. Wycisnąć mniej więcej po połowie zawartości w dwóch miejscach wzdłuż grzbietu kota, najlepiej u podstawy głowy i pomiędzy łopatkami. Ścisnąć pipetkę kilka razy, aby upewnić się, że całość przewidzianej dawki została podana. Unikać nakładania roztworu na sierść oraz nie wcierać roztworu w skórę.
Podanie produktu we wskazany sposób minimalizuje prawdopodobieństwo, że zwierzę zliże roztwór po podaniu.
Należy zadbać o to, by sierść nie została nadmiernie zwilżona produktem, ponieważ w miejscu podania wyglądać będzie na posklejaną. Jeśli jednak do tego dojdzie, wygląd sierści wróci do normy w ciągu 24-48 godzin po zastosowaniu. Badania produktu z udziałem kotów dostarczyły względnie mało danych w tym zakresie, natomiast z badań na psach wynika, że w przeciągu 24-48 godzin po podaniu na sierści mogą pojawić się kryształki i może dojść do nieznacznego łuszczenia.
Harmonogram leczenia:
Minimalny odstęp między kolejnymi podaniami wynosi 4 tygodnie. W niektórych przypadkach może zaistnieć konieczność wydłużenia tego okresu. Stosownej porady należy zasięgnąć u lekarza weterynarii.
Ryzyko działań niepożądanych (patrz punkt 4.6) w przypadku, gdy ten produkt leczniczy weterynaryjny zostanie podany na skórę, jest bardzo niskie. Ryzyko to może wzrosnąć w przypadku przedawkowania, zatem zwierzęta powinny być leczone produktem dobranym do gatunku i masy ciała. Należy upewnić się co do wyboru i stosowania właściwego produktu dla swojego zwierzęcia.
Nie dotyczy
Grupa farmakoterapeutyczna: Produkt przeciwko ektopasożytom do stosowania miejscowego. Kod ATCvet: QP53AX15
Fipronil jest substancją owadobójczą i roztoczobójczą należącą do rodziny fenylopirazoli. Działa jako inhibitor kompleksu GABA, wiążąc się z kanałem chlorkowym i tym samym blokując pre- i postsynaptyczny transport jonów chlorkowych przez błony komórkowe. Skutkuje to niekontrolowaną aktywnością ośrodkowego układu nerwowego i śmiercią owadów lub roztoczy.
Fipronil wykazuje owadobójcze działanie przeciwko pchłom (Ctenocephalides felis) oraz działanie roztoczobójcze przeciwko kleszczom (Dermacentor reticulatus) u kota.
Pchły eliminowane są w ciągu 24 godzin. Kleszcze giną zazwyczaj w ciągu dwóch tygodni po kontakcie z fipronilem.
W warunkach in vitro, fipronil metabolizowany jest głównie poprzez wewnątrzkomórkowe frakcje wątrobowe do swojej pochodnej sulfonowej. Niemniej może mieć to małe znaczenie w warunkach in vivo, ponieważ fipronil jest słabo wchłaniany w przypadku kotów. Stężenie fipronilu na sierści zmniejsza się z upływem czasu.
Butylohydroksyanizol (E320) Butylohydroksytoluen (E321) Glikol propylenowy
Alkohol benzylowy
Glikolu dietylenowego monoetylowy eter
Nieznane
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata
6.4. Specjalne środki ostrożności podczas przechowywania
Przechowywać w temperaturze poniżej 25C. Przechowywać w oryginalnym opakowaniu. Przechowywać w suchym miejscu.
Białe, nieprzezroczyste, różowe lub zielone, półprzezroczyste jednodawkowe pipetki z polipropylenu zawierające roztwór o efektywnej objętości 0,5 ml, zapakowane w przezroczysty blister z PVC powlekany zgrzewaną folią aluminiową, umieszczony w pudełku tekturowym lub karcie blistrowej. Blistry zbiorcze lub pudełka zawierające 1, 2, 3, 4, 5 lub 6 pipetek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Fipronil może mieć działanie szkodliwe na organizmy wodne. Nie należy zanieczyszczać stawów, cieków wodnych lub kanałów produktem leczniczym ani zużytym opakowaniem.
Bob Martin (UK) Ltd Wemberham Lane Yatton
North Somerset BS49 4BS
Wielka Brytania
10 DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB STOSOWANIA
Nie dotyczy











