Spis treści:
- 1. Co to jest lek Gammagard S/D i w jakim celu się go stosuje
- Jak stosować lek Gammagard S/D
- Możliwe działania niepożądane
- Jak przechowywać lek Gammagard S/D
- Zawartość opakowania i inne informacje Co zawiera lek Gammagard S/D
- Uwaga: Odwrócić szybko fiolkę z rozpuszczalnikiem i dołączonym przyrządem do przenoszenia do fiolki z proszkiem, w celu uniknięcia rozlania rozpuszczalnika.
- Podawanie – stosować zasady aseptyki: zestaw 5 g; 10 g
Ulotka dołączona do opakowania: informacja dla użytkownika
GAMMAGARD S/D 50 mg/ml 5 g; 10 g
proszek i rozpuszczalnik do sporządzania roztworu do infuzji
immunoglobulina ludzka normalna (IVIg)
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
1. Co to jest lek Gammagard S/D i w jakim celu się go stosuje
Leczenie pacjentów z pewnymi zaburzeniami o charakterze zapalnym (immunomodulacja). Są trzy grupy tych pacjentów:
Informacje ważne przed zastosowaniem leku Gammagard S/D
Gammagard S/D należy do grupy leków zwanej immunoglobulinami. Leki z tej grupy zawierają ludzkie przeciwciała, które obecne są w ludzkiej krwi. Przeciwciała pomagają organizmowi zwalczać infekcje. Leki takie jak Gammagard S/D stosuje się w przypadku niedoboru przeciwciał we krwi. Pacjenci z niedoborem przeciwciał często zapadają na infekcje. Gammagard S/D może być także użyty, jeśli pacjent potrzebuje dodatkowych przeciwciał w przypadku leczenia niektórych zaburzeń o charakterze zapalnym (chorób autoimmunologicznych).
Gammagard S/D stosuje się w następujących wskazaniach:
Leczenie pacjentów, którzy nie mają wystarczającej ilości przeciwciał (leczenie substytucyjne). Jest sześć grup tych pacjentów:
Kiedy nie stosować leku Gammagard S/D
NIE WOLNO stosować leku Gammagard S/D
jeśli pacjent ma uczulenie na immunoglobuliny lub którykolwiek z pozostałych składników tego leku wymienione w punkcie 6.
w przypadku niedoboru immunoglobuliny A (IgA). We krwi pacjenta mogą występować przeciwciała przeciwko immunoglobulinie A. Aczkolwiek, lek Gammagard S/D zawiera jedynie bardzo małe ilości immunoglobuliny A (nie więcej niż 3 mikrogramy/ml w 5% roztworze).
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania należy omówić to z lekarzem, farmaceutą lub pielęgniarką.
Przez jaki czas podczas infuzji wymagana jest ścisła obserwacja pacjenta
Podczas infuzji leku Gammagard S/D pacjent będzie pozostawać pod ścisłą obserwacją, aby upewnić się, że nie występuje u niego nieprawidłowa reakcja. Lekarz upewni się, że szybkość podawania leku Gammagard S/D jest odpowiednia,
jeśli lek Gammagard S/D jest podawany z dużą szybkością,
jeśli pacjent cierpi na chorobę z niskim poziomem przeciwciał we krwi (hipo- lub
agammaglobulinemię),
u pacjentów, którzy nie otrzymywali wcześniej tego leku,
jeśli była długa przerwa (np. kilka tygodni) od ostatniego przyjęcia leku.
W takich przypadkach w trakcie podawania i jeszcze przez godzinę od zakończenia wlewu pacjent powinien być poddany wnikliwej obserwacji.
Jeśli w ostatnim okresie pacjent przyjmował już lek Gammagard S/D, należy go obserwować w trakcie infuzji oraz przez co najmniej 20 minut po podaniu leku.
Kiedy może być konieczne zmniejszenie szybkości lub przerwanie infuzji
W bardzo rzadkich przypadkach organizm pacjenta może wykazać wrażliwość na leki zawierające przeciwciała. Może to wystąpić zwłaszcza w przypadku niedoboru immunoglobuliny A. W tych rzadkich przypadkach mogą wystąpić reakcje alergiczne, takie jak nagły spadek ciśnienia krwi lub wstrząs nawet, jeśli pacjent był wcześniej leczony lekami zawierającymi przeciwciała.
Jeżeli wystąpią którekolwiek z poniższych objawów ubocznych, należy natychmiast powiadomić lekarza lub pielęgniarkę:
Nagłe zaburzenie oddychania (świszczący oddech), trudności w oddychaniu lub ucisk w klatce piersiowej
Ból głowy
Gorączka
Obrzęk powiek, twarzy, warg lub naczyń krwionośnych
Guzy skóry lub swędzące czerwone plamy
Swędzenie całego ciała.
Zależnie od decyzji lekarza szybkość podawania leku będzie zmniejszona lub infuzja zostanie przerwana.
Specjalne grupy pacjentów
Lekarz zachowa szczególną ostrożność w przypadku pacjentów z nadwagą, w podeszłym wieku, z cukrzycą lub unieruchomionych.
Lekarz będzie ściśle obserwował pacjentów:
cierpiących na nadciśnienie
ze zmniejszoną objętością krwi (hipowolemią)
ze zwiększoną lepkością krwi lub problemami z naczyniami krwionośnymi (chorobami naczyń).
W przypadku takich schorzeń, immunoglobuliny mogą zwiększyć ryzyko zawału serca, udaru, zatoru płuc lub zakrzepicy żył głębokich, chociaż tylko w bardzo rzadkich przypadkach.
Jeśli pacjent choruje na cukrzycę, należy powiedzieć o tym lekarzowi. Gammagard S/D nie zawiera sacharozy ani maltozy. 5% roztwór leku Gammagard S/D zawiera około 20 mg/ml glukozy, co może wpłynąć na poziom cukru we krwi pacjenta.
Lekarz zachowa także szczególną ostrożność
jeśli u pacjenta występują lub występowały problemy z nerkami lub
jeśli pacjent przyjmuje leki, które mogą być szkodliwe dla nerek (leki nefrotoksyczne), ponieważ istnieje bardzo rzadkie ryzyko ostrej niewydolności nerek. Należy poinformować lekarza o wszelkich zaburzeniach nerek.
Zawartość białka może wzrosnąć powodując wzrost lepkości krwi.
Informacje o surowcu, z którego powstaje lek Gammagard S/D
Lek Gammagard S/D wytwarzany jest z ludzkiego osocza (płynnej części krwi). W przypadku otrzymywania leków z ludzkiej krwi lub osocza stosuje się liczne środki zapobiegania przenoszeniu zakażeń. Obejmują one uważną selekcję dawców, aby wykluczyć osoby, u których występuje ryzyko przenoszenia zakażeń, oraz badania poszczególnych donacji i całych pul osocza w kierunku obecności wirusa/zakażenia. Wytwórcy tego typu leków włączają ponadto do procesu obróbki krwi i osocza etapy inaktywacji lub usuwania wirusów. Pomimo tego nie można całkowicie wykluczyć możliwości przeniesienia czynników zakaźnych podczas podawania leków otrzymanych z ludzkiej krwi lub osocza. Dotyczy to także wirusów nieznanych lub nowo odkrytych oraz innych rodzajów infekcji.
Działania podejmowane podczas wytwarzania leku Gammagard S/D są uznawane za skuteczne
w stosunku do wirusów osłonkowych, takich jak ludzki wirus nabytego niedoboru odporności (HIV), wirus zapalenia wątroby typu B i wirus zapalenia wątroby typu C oraz wobec bezosłonkowych wirusa zapalenia wątroby typu A i parwowirusa B19. Lek Gammagard S/D zawiera ponadto określone przeciwciała, które mogą zapobiegać zakażeniom wirusem zapalenia wątroby typu A lub parwowirusem B19.
Lek Gammagard S/D a inne leki
Należy powiedzieć lekarzowi lub farmaceucie o wszystkich lekach stosowanych przez pacjenta obecnie lub ostatnio, a także o lekach, które pacjent planuje stosować lub o szczepieniach otrzymanych w ciągu ostatnich sześciu tygodni.
Wlew immunoglobulin takich jak lek Gammagard S/D może osłabiać skuteczność niektórych szczepionek zawierających żywe wirusy, takie jak wirus: odry, różyczki, świnki i ospy wietrznej. Szczepienie szczepionkami zawierającymi żywe, atenuowane wirusy powinno być przeprowadzane dopiero po 3 miesiącach od ostatniego podania leku Gammagard S/D.
W przypadku szczepionki przeciwko odrze może być konieczne wydłużenie tego okresu do roku.
Wpływ na badania krwi
Lek Gammagard S/D zawiera szeroką gamę różnorodnych przeciwciał, spośród których część może wpływać na wyniki badań krwi. W przypadku poddawania się badaniom krwi należy poinformować osobę pobierającą krew lub lekarza o przyjmowaniu leku Gammagard S/D.
Podawanie ludzkich immunoglobulin może powodować fałszywie dodatnie wyniki oznaczania obecności beta-D-glukanów w surowicy w diagnostyce zakażeń grzybiczych; ten stan może się utrzymywać przez dłuższy czas po infuzji leku.
Ciąża, karmienie piersią i wpływ na płodność
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza, że może być w ciąży lub gdy planuje mieć dziecko, powinna poradzić się lekarza lub farmaceuty przed zastosowaniem tego leku.
Lekarz zdecyduje, czy można zastosować lek Gammagard S/D w czasie ciąży lub karmienia piersią.
Nie przeprowadzono żadnych badań klinicznych z zastosowaniem leku Gammagard S/D
u kobiet w ciąży lub karmiących piersią. Długotrwałe doświadczenie kliniczne ze stosowaniem leków zawierających przeciwciała wskazuje, że nie mają one szkodliwego wpływu na przebieg ciąży, płód ani noworodka.
W przypadku karmienia piersią przeciwciała zawarte w leku Gammagard S/D mogą pojawiać się w mleku matki. W ten sposób dziecko może być chronione przed określonymi zakażeniami.
Prowadzenie pojazdów i obsługiwanie maszyn
Pacjenci mogą odczuwać objawy (np. nudności lub zawroty głowy) podczas przyjmowania leku Gammagard S/D, które mogą wpływać na zdolność prowadzenia pojazdów i obsługiwanie maszyn. Jeśli to wystąpi, należy poczekać do ustąpienia tych objawów.
Ważne informacje o niektórych składnikach leku Gammagard S/D
Lek zawiera około 2,0 g glukozy na fiolkę z 5 g oraz około 4,0 g glukozy na fiolkę z 10 g. Należy wziąć to pod uwagę u pacjentów z cukrzycą.
Lek zawiera około 334 mg sodu (głównego składnika soli kuchennej) w każdej fiolce z 5 g oraz około 668 mg sodu w każdej fiolce z 10 g . Odpowiada to odpowiednio około 17% oraz około 34% maksymalnej zalecanej dobowej dawki sodu w diecie u osób dorosłych.
Jak stosować lek Gammagard S/D
Lek Gammagard S/D jest przeznaczony do podawania dożylnego (wlew dożylny). Lek podaje lekarz lub pielęgniarka. Sposób dawkowania oraz częstość wlewów różni się w zależności od stanu klinicznego pacjenta i wagi ciała.
Początkowo lek Gammagard S/D podawany będzie z małą szybkością. W zależności od tego, jak wlew będzie tolerowany, lekarz może stopniowo zwiększać szybkość wlewu.
Stosowanie u dzieci
Te same wskazania, dawkowanie oraz częstość wlewów dotyczy dorosłych i dzieci (w wieku 0-18 lat).
Zastosowanie większej niż zalecana dawki leku Gammagard S/D
Przedawkowanie leku może prowadzić do nadmiernego zagęszczenia krwi (nadmiernej lepkości krwi). Im gęstsza staje się krew, tym trudniej przemieszcza się ona w naczyniach w ciele pacjenta. W wyniku tego mniej tlenu zostaje dostarczone do ważnych narządów takich jak mózg, płuca itp. Może to wystąpić zwłaszcza u pacjentów z grupy ryzyka, tj. pacjentów w podeszłym wieku lub pacjentów mających problemy z sercem lub nerkami. Należy upewnić się, że pacjent przyjął odpowiednią ilość płynów i nie jest odwodniony oraz powiedzieć lekarzowi o problemach zdrowotnych.
Możliwe działania niepożądane
Częste lub niezbyt częste działania niepożądane (które występują u mniej niż 1 na
10 pacjentów, ale więcej niż u 1 na 1 000 pacjentów) to: dreszcze, bóle głowy, gorączka, wymioty, reakcje alergiczne, nudności (uczucie mdłości), bóle stawów, obniżone ciśnienie krwi i umiarkowane bóle pleców.
Rzadkie działania niepożądane, które występują u mniej niż u 1 na 1000 pacjentów to:
przypadki nagłego spadku ciśnienia krwi
przypadki objawów przypominających wyprysk (przejściowe reakcje skórne)
Bardzo rzadkie działania niepożądane, które występują u mniej niż 1 na 10 000 pacjentów lub których nie można oszacować na podstawie dostępnych danych to:
pojedyncze przypadki reakcji alergicznych (wstrząs anafilaktyczny), także u pacjentów, którzy nie wykazywali żadnych reakcji na poprzednie podania,
przypadki przejściowego zapalenia opon mózgowo-rdzeniowych (przemijające aseptyczne zapalenie opon mózgowo-rdzeniowych),
pojedyncze przypadki przejściowego spadku liczby krwinek czerwonych (odwracalna niedokrwistość hemolityczna/hemoliza),
przejściowe zwiększenie wskaźników wątrobowych (transaminazy wątrobowe), wzrost poziomu kreatyniny we krwi oraz niewydolność nerek,
zakrzepy krwi w żyłach (reakcje zakrzepowo-zatorowe), które mogą prowadzić do
zawału serca, schorzeń płuc (zatorowość płuc) i zakrzepicy żył głębokich.
Poniżej znajduje się lista działań niepożądanych, które były zgłoszone w trakcie badań klinicznych
z zastosowaniem leku Gammagard S/D oraz po wprowadzeniu leku do obrotu:
Bardzo rzadkie działania niepożądane, które występują u mniej niż 1 na 10 000 pacjentów lub których nie można oszacować na podstawie dostępnych danych: brak
Częste działania niepożądane (które występują u mniej niż 1 na 10 pacjentów) to: ból głowy, zaczerwienienie twarzy, nudności, wymioty, zmęczenie, dreszcze, gorączka.
Nieczęste działania niepożądane (które występują u mniej niż 1 na 100 pacjentów): grypa, nerwowość, pobudzenie, nieprawidłowa senność, rozmazane widzenie, nieregularne bicie serca, skrócenie oddechu, krwawienie z nosa, biegunka, ból w nadbrzuszu, uczucie dyskomfortu
w żołądku, stan zapalny jamy ustnej, świąd, pokrzywka, zimne poty, nadmierne pocenie się, ból pleców, kurcze mięśni, bole kończyn, ból w klatce piersiowej, złe samopoczucie, uczucie zimna, uczucie gorąca, objawy grypopodobne, zaczerwienienie w miejscu wlewu, ślad po wkłuciu, ból w miejscu wlewu, uczucie rozbicia, ból, podwyższone ciśnienie tętnicze, wahania ciśnienia krwi, utrata apetytu,
działania niepożądane o nieznanej częstości: (nie można oszacować na podstawie dostępnych danych) to:
Jak przechowywać lek Gammagard S/D
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na etykiecie
i opakowaniu leku. Termin ważności oznacza ostatni dzień podanego miesiąca.
Nie stosować tego leku, jeśli zauważy się cząstki stałe lub jest zmiana barwy.
Przechowywać w temperaturze poniżej 25°C.
Nie zamrażać.
Fiolki przechowywać w zewnętrznym opakowaniu kartonowym w celu ochrony przed światłem.
Substancją czynną leku Gammagard S/D jest normalna ludzka immunoglobulina.
Lek Gammagard S/D rekonstytuuje się w wodzie do wstrzykiwań do uzyskania 5% (50 mg/ml)
roztworu białka. Co najmniej 90% białka stanowi immunoglobulina G (IgG).
Lek Gammagard S/D może być rekonstytuowany w wodzie do wstrzykiwań do uzyskania 10% (100 mg/ml) roztworu białka.
Pozostałe składniki to: albumina ludzka, glicyna, sodu chlorek i glukoza jednowodna.
Jak wygląda lek Gammagard S/D i co zawiera opakowanie
Lek Gammagard S/D to liofilizowany, biały lub bladożółty proszek, bez widocznych, obcych cząstek.
Lek Gammagard S/D dostępny jest w następujących wielkościach opakowań: 5 g i 10 g.
Lek Gammagard S/D; 5 g i 10 g: Każde opakowanie zawiera
fiolkę z proszkiem po 5 g lub 10 g
96 ml lub 192 ml wody do wstrzykiwań
przyrząd do przenoszenia
zestaw do podawania wyposażony w filtr.
Podmiot odpowiedzialny Takeda Pharma Sp. z o.o. ul. Prosta 68
00-838 Warszawa
Wytwórca
Baxalta Belgium Manufacturing SA
Boulevard René Branquart 80 7860 Lessines, Belgia
Data ostatniej aktualizacji ulotki:
------------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego: Specjalne środki ostrożności przy przechowywaniu
Jeżeli sporządzanie roztworu odbywa się w warunkach aseptycznych poza komorą z nawiewem laminarnym, podawanie należy rozpocząć tak szybko jak to możliwe, ale nie później niż 2 godziny po sporządzeniu roztworu. Jeżeli sporządzanie roztworu odbywa się w warunkach aseptycznych
w komorze z nawiewem laminarnym, gotowy lek można przechowywać w warunkach chłodniczych (2C 8C), do 24 godzin. Jeżeli warunki te nie są spełnione, sterylność rozpuszczonego produktu może nie być utrzymana. Fiolki z częściowo zużytym roztworem należy zniszczyć zgodnie
z obowiązującymi procedurami.
Rekonstytucja – stosować zasady aseptyki:
Należy podawać wyłącznie roztwór, który po rekonstytucji jest klarowny lub lekko opalizujący
i bezbarwny lub bladożółty.
zestaw 5 g; 10 g
roztwór 5%:
UWAGA: Wkłucie ostrza poza środek korka może spowodować przemieszczenie korka.
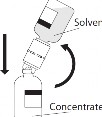
Uwaga: Odwrócić szybko fiolkę z rozpuszczalnikiem i dołączonym przyrządem do przenoszenia do fiolki z proszkiem, w celu uniknięcia rozlania rozpuszczalnika.
Uwaga: Wkłucie ostrza poza środek korka może spowodować przemieszczenie korka i utratę próżni.
Podawanie – stosować zasady aseptyki: zestaw 5 g; 10 g
Proszek powinien całkowicie rozpuścić się w ciągu 30 minut.
Lek przed użyciem należy ogrzać do temperatury pokojowej lub temperatury ciała.
Roztwór powinien być klarowny lub lekko opalizujący i bezbarwny lub bladożółty. Roztwór mętny lub zawierający osad nie nadaje się do użytku. Roztwór po rekonstytucji powinien być oceniony wizualnie przed podaniem na obecność nierozpuszczalnych cząstek i przebarwień.
Niezużyty lek lub pozostałości roztworu powinny być usuwane zgodnie z obowiązującą procedurą.
Przyrząd do przenoszenia wyrzucić po jednorazowym użyciu.
Sposób podawania
Do podawania dożylnego.
Jeśli jest to możliwe, zaleca się podawanie 10% roztworów gammaglobulin do żył zgięcia łokciowego. Może to zmniejszyć prawdopodobieństwo dyskomfortu odczuwanego przez pacjenta w miejscu podania.
Lek Gammagard S/D w postaci 5% roztworu (50 mg/ml) należy podawać dożylnie z początkową szybkością 0,5 ml/kg mc./godzinę. Ogólnie zaleca się, aby u pacjentów rozpoczynających leczenie lekiem Gammagard S/D lub przy zmianie immunoglobuliny jednego wytwórcy na lek innego wytwórcy, rozpoczynać podawanie z najmniejszą szybkością, a następnie zwiększając ją do szybkości maksymalnej, jeśli pacjenci tolerują kilka wlewów podanych ze średnią szybkością. Jeżeli wlew jest dobrze tolerowany, szybkość podawania można stopniowo zwiększać do wartości maksymalnej 4,0 ml/kg mc./godzinę.
W przypadku pacjentów, którzy dobrze tolerują podawanie 5% roztworu leku Gammagard S/D z szybkością 4 ml/kg mc./godzinę, można rozpocząć podawanie roztworu 10% z początkową
szybkością 0,5 ml/kg mc./godzinę. Jeżeli nie wystąpią żadne objawy niepożądane szybkość wlewu można stopniowo zwiększać, maksymalnie do 8 ml/kg mc./godzinę.
Ostrzeżenia specjalne
W przypadku jakichkolwiek działań niepożądanych mających związek z infuzją należy zmniejszyć szybkość podawania lub przerwać wlew.
Zaleca się, aby po każdorazowym podaniu leku Gammagard S/D odnotowywać jego nazwę
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią. Tym niemniej, możliwe działania niepożądane można ograniczyć poprzez zmniejszenie szybkości infuzji.
Następujące działania niepożądane mogą wystąpić po leczeniu immunoglobulinami (lekami takimi jak
lek Gammagard S/D):
aseptyczne zapalenie opon mózgowo-rdzeniowych, niszczenie czerwonych krwinek krwi, zmniejszenie liczby czerwonych krwinek krwi, zmniejszenie liczby płytek krwi, powiększenie węzłów chłonnych, wszystkie stopnie nasilenia reakcji alergicznych włącznie ze wstrząsem alergicznym, niepokój, zawroty głowy, nieprawidłowe zmiany na skórze, drżenie, napady padaczkowe, krwotok do mózgu, migrena, utrata świadomości, światłowstręt, zaburzenia widzenia, ból oka, zamknięcie głównej żyły w oku, zawał serca, niebieskawy odcień skóry, wzrost częstości bicia serca, zmniejszenie częstości bicia serca, podwyższone ciśnienie krwi, bladość, niskie ciśnienie krwi, zapalenie żył, zamknięcie naczyń krwionośnych, kaszel, ucisk
w gardle, zmniejszenie stężenia tlenu we krwi, hiperwentylacja, świszczący oddech, skurcz dróg oddechowych, zamknięcie naczyń krwionośnych w płucach, płyn w płucach, zaburzenia trawienia, ból brzucha, zapalenie wątroby (niezakaźne), zaczerwienienie skóry, wyprysk na skórze, zapalenie skóry, alergiczne opuchnięcie głębokich warstw skóry, ból stawów i mięśni, niewydolność nerek, ogólne osłabienie, opuchnięcie tkanek ciała, reakcje w miejscu wkłucia
i wlewu, dreszcze, dodatni wynik testu Coombsa.
Jeżeli nasili się którykolwiek z objawów niepożądanych lub wystąpią jakiekolwiek objawy niepożądane niewymienione w tej ulotce, należy powiadomić lekarza, farmaceutę lub pielęgniarkę.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi lub farmaceucie. Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181 C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Podać roztwór zgodnie z instrukcją użycia załączoną do zestawu do podawania dożylnego, który znajduje się w każdym opakowaniu. W przypadku zastosowania innego zestawu należy upewnić się, czy zawiera on podobny filtr.
Instrukcje dotyczące przygotowania leku do stosowania i usuwania jego pozostałości
i numer serii.
Niezgodności farmaceutyczne
Nie wolno mieszać leku Gammagard S/D z innymi lekami.
Zaleca się, aby lek Gammagard S/D podawać osobno w przypadku, gdy pacjent przyjmuje jednocześnie inne leki.
Zalecenia odnośnie dawkowania
Dawka | ||
Leczenie substytucyjne w zespołach pierwotnych niedoborów odporności Leczenie substytucyjne w zespołach wtórnych niedoborów odporności Wrodzony zespół AIDS Wcześniaki z niską masą urodzeniową (niemowlęta do 7 dnia życia) Hipogammaglobulinemia (<4 g/l) u pacjentów po alogenicznym przeszczepie komórek macierzystych - Leczenie zakażeń i profilaktyka choroby przeszczep przeciw gospodarzowi -Trwały niedobór wytwarzania przeciwciał | dawka początkowa: 0,4 – 0,8 g/kg mc. następnie: 0,2 – 0,8 g/kg mc. 0,2 – 0,4 g/kg mc. 0,2 – 0,4 g/kg mc. 0,5 g/kg mc. 0,2 – 0,4 g/kg mc. | co 3 – 4 tygodnie do uzyskania poziomu IgG co najmniej 5,0 – 6,0 g/l co 3 – 4 tygodnie do uzyskania poziomu IgG co najmniej 5,0 – 6,0 g/l co 3 – 4 tygodnie 2 wlewy w odstępie 1 tygodnia, a następnie kolejne 5 wlewów co 14 dni lub do czasu wypisu ze szpitala co 3 – 4 tygodnie do uzyskania poziomu IgG co najmniej 5,0 g/l raz na tydzień, zaczynając od 7 dnia przed i kontynuując do 3 miesięcy po przeszczepie raz na miesiąc do czasu przywrócenia prawidłowego poziomu przeciwciał |
Immunomodulacja: Pierwotna małopłytkowość immunologiczna (ITP) Zespół Guillain Barré Choroba Kawasaki | 0,8 – 1,0 g/kg mc. lub 0,4 g/kg mc./dobę 0,4 g/kg mc./dobę 1,6 – 2,0 g/kg mc. lub 2,0 g/kg mc. | Pierwszego dnia, z możliwością powtórzenia jeden raz w przeciągu 3 dni przez 2 – 5 dni przez 5 dni w kilku dawkach podzielonych przez 2 – 5 dni w połączeniu z kwasem acetylosalicylowym jako pojedyncza dawka w połączeniu z kwasem acetylosalicylowym |











