Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- Uwaga: Odwrócić szybko fiolkę z rozpuszczalnikiem i dołączonym przyrządem do przenoszenia do fiolki z proszkiem, w celu uniknięcia rozlania rozpuszczalnika.
- Podawanie – stosować zasady aseptyki:
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Zespoły pierwotnych niedoborów odporności (PNO) z zaburzeniem wytwarzania przeciwciał (patrz punkt 4.4).
Hipogammaglobulinemia i nawracające zakażenia bakteryjne u pacjentów z przewlekłą białaczką limfocytową, u których zawiodło profilaktyczne leczenie antybiotykami.
Hipogammaglobulinemia i nawracające zakażenia bakteryjne u pacjentów w fazie
plateau szpiczaka mnogiego, którzy nie zareagowali na profilaktyczne uodparnianie przeciw pneumokokom.
Hipogammaglobulinemia u pacjentów po alogenicznym przeszczepie komórek macierzystych
(ang. allogeneic haematopoietic stem cell transplantation HSCT).
Wrodzone AIDS z nawracającymi zakażeniami bakteryjnymi.
Wcześniaki z małą masą urodzeniową.
Immunomodulacja u dorosłych, dzieci i młodzieży (0-18 lat) w:
pierwotnej małopłytkowości immunologicznej (ang. ITP) u pacjentów z wysokim ryzykiem krwawienia lub przed zabiegiem chirurgicznym w celu skorygowania liczby płytek krwi
zespole Guillain-Barré
chorobie Kawasaki.
Alogeniczny przeszczep szpiku
Dawkowanie i sposób podawania
0,8–1 g/kg mc. w pierwszym dniu leczenia, dawkę można powtórzyć jeden raz w ciągu 3 dni.
0,4 g/kg mc. na dobę przez dwa do pięciu dni.
Leczenie można powtórzyć w przypadku nawrotu choroby. Zespół Guillain Barré:
0,4 g/kg mc./dobę przez 5 dni.
Zespół Kawasaki:
Należy podać 1,6 – 2,0 g/kg mc. w dawkach podzielonych przez 2 - 5 dni lub 2,0 g/kg mc.
w jednorazowej dawce. Równocześnie należy podawać pacjentowi kwas acetylosalicylowy. Zalecenia odnośnie dawkowania zebrane są w poniższej tabeli:
Dawka
Leczenie substytucyjne w zespołach pierwotnych niedoborów odporności
Leczenie substytucyjne w zespołach wtórnych niedoborów odporności
Wrodzony zespół AIDS
Wcześniaki z małą masą urodzeniową (niemowlęta do 7 dnia życia)
Hipogammaglobulinemia (<4 g/l) u pacjentów po alogenicznym
przeszczepie komórek macierzystych
- Leczenie zakażeń i profilaktyka choroby przeszczep przeciw gospodarzowi
-Trwały niedobór wytwarzania przeciwciał
dawka początkowa:
0,4 – 0,8 g/kg mc. następnie:
0,2 – 0,8 g/kg mc.
0,2 – 0,4 g/kg mc.
0,2 – 0,4 g/kg mc.
0,5 g/kg mc.
0,2 – 0,4 g/kg mc.
co 3 – 4 tygodnie do uzyskania poziomu IgG co najmniej 5,0 – 6,0 g/l
co 3 – 4 tygodnie do uzyskania poziomu IgG co najmniej 5,0 – 6,0 g/l
co 3 – 4 tygodnie
2 wlewy w odstępie 1 tygodnia, a następnie kolejne 5 wlewów co 14 dni lub do czasu wypisu ze szpitala
co 3 – 4 tygodnie do uzyskania poziomu IgG co najmniej 5,0 g/l
raz na tydzień, zaczynając od 7 dnia przed
i kontynuując do 3 miesięcy po przeszczepie
raz na miesiąc do czasu przywrócenia prawidłowego poziomu przeciwciał
Immunomodulacja:
Pierwotna małopłytkowość
immunologiczna (ITP)
Zespół Guillain Barré Choroba Kawasaki
0,8 – 1,0 g/kg mc.
lub
0,4 g/kg mc./dobę
0,4 g/kg mc./dobę
1,6 – 2,0 g/kg mc.
lub
2,0 g/kg mc.
Pierwszego dnia, z możliwością powtórzenia
w przeciągu 3 dni
przez 2 – 5 dni
przez 5 dni
w kilku dawkach podzielonych przez 2 – 5 dni w połączeniu z kwasem acetylosalicylowym
jako pojedyncza dawka w połączeniu z kwasem
acetylosalicylowym
Dzieci i młodzież
Dawkowanie u dzieci i młodzieży (0–18 lat) nie różni się od dawkowania u dorosłych, ponieważ
w przypadku każdego ze wskazań, dawkowanie jest określane na podstawie masy ciała i dostosowane do odpowiedzi klinicznej w stanach wymienionych powyżej.
Do podawania dożylnego.
Niektóre działania niepożądane, takie jak ból głowy i nagłe zaczerwienienie twarzy mogą być związane z szybkością infuzji. Zmniejszenie szybkości infuzji lub jej zatrzymanie zazwyczaj powoduje ustąpienie objawów. Wtedy infuzja może zostać wznowiona z szybkością, która nie spowoduje ponownego pojawienia się objawów (patrz punkt 4.8).
Jeśli jest to możliwe, zaleca się podawanie 10% roztworów gammaglobulin do żył zgięcia łokciowego. Może to zmniejszyć prawdopodobieństwo dyskomfortu, odczuwanego przez pacjenta w miejscu podania.
GAMMAGARD S/D w postaci 5% roztworu (50 mg/ml) należy podawać dożylnie z początkową szybkością 0,5 ml/kg mc./godzinę. Ogólnie zaleca się, aby u pacjentów rozpoczynających leczenie produktem Gammagard S/D lub przy zmianie immunogloguliny dożylnej jednego wytwórcy na Gammagard S/D, rozpoczynać podawanie z najmniejszą szybkością, a następnie zwiększać ją do szybkości maksymalnej, jeśli pacjenci tolerują kilka wlewów podanych ze średnią szybkością (patrz także punkt 4.4).
GAMMAGARD S/D może być rekonstytuowany w wodzie do wstrzykiwań do uzyskania 5%
(50 mg/ml) lub 10% (100 mg/ml) roztworu białka.
Jeżeli wlew jest dobrze tolerowany, szybkość podawania można stopniowo zwiększać do wartości maksymalnej 4,0 ml/kg mc./godzinę. W przypadku pacjentów, którzy dobrze tolerują podawanie 5% roztworu GAMMAGARD S/D z szybkością 4 ml/kg/godzinę, można rozpocząć podawanie roztworu 10% z początkową szybkością 0,5 ml/kg mc./godzinę. Jeżeli nie wystąpią żadne objawy niepożądane szybkość wlewu można stopniowo zwiększać, maksymalnie do 8 ml/kg mc./godzinę.
W przypadku zmiany z roztworu 5% na 10 %, szybkość podawania roztworu 10% należy początkowo zmniejszyć tak, aby uzyskać porównywalną szybkość podawania białka IgG.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
w przypadku dużej szybkości wlewu;
u pacjentów z hipo- lub agammaglobulinemią z niedoborem lub bez niedoboru IgA;
u pacjentów z niedoborem odporności po raz pierwszy przyjmujących normalne ludzkie immunoglobuliny lub w rzadkich przypadkach, jeżeli zmieniono produkt immunoglobulin na inny, lub w przypadku długiej przerwy od ostatniego podania.
pacjenci nie są uczuleni na normalną ludzką immunoglobulinę, podając produkt po raz pierwszy
w powolnym wlewie (0,5 do 1 ml/kg mc./godz.);
w trakcie podawania produktu leczniczego pacjenci są pod wnikliwą obserwacją pod kątem wystąpienia jakichkolwiek objawów. Szczególną uwagę należy poświęcić pacjentom, którzy otrzymują ludzkie immunoglobuliny po raz pierwszy, pacjentom, którzy wcześniej otrzymywali inny dożylny produkt immunoglobulin (IVIg) lub gdy od ostatniego podania upłynął długi czas. W celu wykrycia potencjalnych oznak działań niepożądanych pacjenci ci powinni być obserwowani w trakcie pierwszego wlewu i przez godzinę od jego zakończenia. Wszyscy inni pacjenci powinni być obserwowani co najmniej przez 20 minut po podaniu produkt leczniczego.
przed podaniem produktu leczniczego pacjentom chorym na cukrzycę jawną lub ukrytą
zapewnić dostateczne nawodnienie pacjenta przed rozpoczęciem wlewu IVIg
monitorować ilość wydalanego moczu
monitorować poziom kreatyniny w surowicy
unikać jednoczesnego stosowania leków moczopędnych pętlowych.
W badaniach płynu mózgowo-rdzeniowego często stwierdza się pleocytozę do kilku tysięcy
komórek na mm3, głównie granulocytów, oraz stężenia białka podwyższone do kilkuset mg/dl.
AMS może występować częściej u kobiet.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki dotyczące usuwania i przygotowania produktu leczniczego do stosowania
roztwór 5%:
UWAGA: Wkłucie ostrza poza środek korka może spowodować przemieszczenie korka.
Uwaga: Odwrócić szybko fiolkę z rozpuszczalnikiem i dołączonym przyrządem do przenoszenia do fiolki z proszkiem, w celu uniknięcia rozlania rozpuszczalnika.
Podawanie – stosować zasady aseptyki:
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
GAMMAGARD S/D 50 mg/ml; 5 g; 10 g proszek i rozpuszczalnik do sporządzania roztworu do infuzji
Immunoglobulina ludzka normalna (IVIg)
GAMMAGARD S/D występuje w postaci proszku i rozpuszczalnika do sporządzania roztworu do infuzji, zawierającego 5 g; 10, g normalnej ludzkiej immunoglobuliny (IVIg) na fiolkę, w tym co najmniej 90% białka stanowi immunoglobulina G (IgG).
Skład podklas IgG:
IgG1 ≥56,9% IgG2 ≥16,0% IgG3 ≥3,3% IgG4 ≥0,3%
Maksymalna zawartość immunoglobuliny A (IgA): nie więcej niż 3 mikrogramy na ml
w 5% roztworze.
Produkt leczniczy wytwarzany z ludzkiego osocza dawców.
Substancje pomocnicze o znanym działaniu: albumina ludzka, glicyna, sodu chlorek, glukoza jednowodna
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Proszek i rozpuszczalnik do sporządzania roztworu do infuzji
GAMMAGARD S/D to liofilizowany, biały lub bladożółty proszek/zbita substancja, zasadniczo nie
zawiera obcych cząstek widocznych gołym okiem.
Leczenie substytucyjne dorosłych, dzieci i młodzieży (0-18 lat) w następujących stanach:
Leczenie substytucyjne należy rozpoczynać i monitorować pod opieką lekarza doświadczonego
w leczeniu niedoborów odporności.
Dawkowanie
Wielkość dawki i sposób dawkowania są zależne od wskazania.
W leczeniu substytucyjnym może być konieczne indywidualne ustalenie dawki dla pacjenta
w zależności od odpowiedzi farmakokinetycznej i klinicznej na produkt leczniczy. Poniższe schematy dawkowania podane są jako wskazówki.
Leczenie substytucyjne w pierwotnych niedoborach odporności:
Sposób dawkowania powinien być tak dobrany, aby udało się osiągnąć poziom IgG (mierzony przed kolejnym podaniem produktu) co najmniej 5,0 – 6,0 g/l. Do wyrównania poziomu potrzebny jest okres 3-6 miesięcy. Zalecana dawka początkowa to: 0,4 – 0,8 g/kg mc., a następnie 0,2 g/kg mc. co trzy do czterech tygodni.
Dawka wymagana do osiągnięcia poziomu IgG 5,0-6,0 g/l wynosi 0,2 – 0,8 g/kg mc./miesiąc. Po osiągnięciu stanu stabilnego, przerwy pomiędzy kolejnymi podaniami produktu leczniczego powinny wynosić od 3-4 tygodni.
Należy dokonywać oznaczania i oceny poziomu immunoglobuliny w zależności od częstości występowania zakażeń. W celu zmniejszenia częstości występowania zakażeń może być konieczne zwiększenie dawki w celu uzyskania wyższego poziomu immunoglobuliny.
Hipogammaglobulinemia i nawracające zakażenia bakteryjne u pacjentów z przewlekłą białaczką limfocytową, u których zawiodło profilaktyczne leczenie antybiotykami; hipogammaglobulinemia i nawracające zakażenia bakteryjne u pacjentów w fazie plateau szpiczaka mnogiego, którzy nie
zareagowali na profilaktyczne uodparnianie przeciw pneumokokom, dzieci i młodzież z wrodzonym AIDS i nawracającymi zakażeniami bakteryjnymi:
Zalecana dawka wynosi 0,2–0,4 g/kg mc. co trzy do czterech tygodni.
Wcześniaki z małą masą urodzeniową:
W celu zapobiegania zakażeniom wtórnym u wcześniaków z małą masą urodzeniową, noworodkom w wieku poniżej 7 dni należy podać 0,5 g/kg mc. i taką samą dawkę tydzień później, a następnie kolejne 5 wlewów co 14 dni lub do momentu wypisania ze szpitala.
Hipogammaglobulinemia u pacjentów po alogenicznym przeszczepie komórek macierzystych:
W celu leczenia zakażeń i profilaktyki choroby przeszczep przeciw gospodarzowi, dawka jest ustalana indywidualnie.
Zalecana dawka wynosi 0,2–0,4 g/kg co trzy do czterech tygodni. Należy utrzymywać stężenia
minimalne powyżej 5 g/l.
Pierwotna małopłytkowość immunologiczna:
Istnieją dwa możliwe schematy leczenia:
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną
w punkcie 6.1
Nadwrażliwość na ludzkie immunoglobuliny, szczególnie u pacjentów posiadających przeciwciała przeciw IgA.
GAMMAGARD S/D zawiera nie więcej niż 3 mikrogramy IgA na ml w 5% roztworze. GAMMAGARD S/D jest przeciwwskazany u pacjentów z potwierdzoną reakcją anafilaktyczną lub ciężką nadwrażliwością na GAMMAGARD S/D zawierający < 3 mikrogramy IgA na ml
w 5% roztworze.
Wystąpienie niektórych poważnych działań niepożądanych może być związane z szybkością wlewu dożylnego. Należy ściśle przestrzegać zalecanej szybkości wlewu podanej w punkcie 4.2 „Sposób podawania.” W czasie podawania produktu, pacjent musi być pod stałą obserwacją.
Niektóre działania niepożądane mogą występować częściej:
W wielu przypadkach można uniknąć wystąpienia możliwych powikłań upewniając się, że:
z przejściową glukozurią oraz pacjentom na diecie z niską zawartością cukru uwzględniono zawartość glukozy w produkcie (maksymalna zawartość 0,4 g/g IgG).
Podając dożylny produkt immunoglobulin IVIg należy u wszystkich pacjentów:
W przypadku wystąpienia objawów niepożądanych należy zmniejszyć szybkość podawania lub przerwać wlew. Sposób postępowania zależy od rodzaju i ciężkości obserwowanych objawów ubocznych. W przypadku wstrząsu należy zastosować standardowe postępowanie lecznicze w takiej sytuacji.
Nadwrażliwość
Prawdziwe objawy nadwrażliwości występują sporadycznie. Mogą pojawić się w bardzo rzadkich przypadkach niedoboru IgA z występowaniem przeciwciał przeciwko IgA.
Ci pacjenci powinni być leczeni jedynie, gdy ich niedobór IgA jest związany z niedoborem immunologicznym, który powinien być leczony immunoglobulinami dożylnymi.
Normalne ludzkie immunoglobuliny rzadko mogą wywołać reakcje anafilaktyczną ze spadkiem
ciśnienia, nawet u pacjentów, którzy wcześniej dobrze tolerowali leczenie tego typu produktami.
U pacjentów, u których występują przeciwciała przeciwko IgA lub z niedoborem IgA, jako pierwotnej przyczyny niedoborów immunoglobulin, dla których jest wskazane leczenie IVIg, może występować zwiększone ryzyko reakcji anafilaktycznej. Anafilaksja po zastosowaniu produktu leczniczego Gammagard S/D była raportowana, nawet przy małej zawartości IgA (patrz punkt 4.8). Pacjenci,
u których wystąpiła ciężka reakcja nadwrażliwości powinni otrzymywać Gammagard S/D ze szczególną ostrożnością i jedynie, gdy jest dostępna opieka medyczna stosowana w reakcjach zagrażających życiu.
Epizody zatorowo-zakrzepowe
Istnieją kliniczne dowody potwierdzające związek pomiędzy leczeniem IVIg (w tym produktem leczniczym GAMMAGARD S/D) i epizodami zakrzepowymi i zakrzepowo-zatorowymi, takimi jak zawał mięśnia sercowego, incydent naczyniowo-mózgowy, zakrzepica żył głębokich i zatorowość
płucna; przypuszcza się, że ich występowanie jest związane z relatywnym wzrostem lepkości krwi
wskutek wysokiej podaży immunoglobulin u pacjentów z grup ryzyka.
Należy zachować ostrożność, przepisując i podając wlewy dożylne IVIg u pacjentów z nadwagą oraz u pacjentów z istniejącymi czynnikami ryzyka wystąpienia epizodów zakrzepowych (podanymi
w wywiadzie takie jak: miażdżyca naczyń, obecność licznych czynników ryzyka kardiologicznego, podeszły wiek, nieprawidłowa pojemność minutowa serca, rozpoznana lub podejrzewana nadlepkość krwi, na przykład podczas odwodnienia lub występowania paraprotein, chorób przebiegających
z nadkrzepliwością, okresy długotrwałego unieruchomienia, otyłość, cukrzyca, nabyte lub wrodzone zaburzenia zakrzepowe, choroby naczyń, epizody zakrzepowe lub zakrzepowo-zatorowe).
U pacjentów z ryzykiem wystąpienia działań niepożądanych o charakterze zatorowo-zakrzepowym GAMMAGARD S/D należy podawać z minimalną szybkością wlewu i w najmniejszej stosowanej dawce.
Należy zapewnić odpowiednie nawodnienie pacjentów przed podaniem produktu leczniczego. Pacjentów z ryzykiem nadmiernej lepkości krwi należy monitorować pod kątem oznak oraz objawów zakrzepicy oraz ocenić lepkość krwi.
Ostra niewydolność nerek
U pacjentów leczonych IVIg odnotowano przypadki ciężkich reakcji niepożądanych dotyczących nerek. Obejmują one: ostrą niewydolność nerek, ostrą martwicę kanalików nerkowych, nefropatię kanalików bliższych i nerczycę osmotyczną. U większości pacjentów wykryto występowanie czynników ryzyka, takich jak: istniejąca niewydolność nerek, cukrzyca, hipowolemia, nadwaga, jednoczesne przyjmowanie leków uszkadzających czynność nerek (nefrotoksycznych), wiek powyżej 65 lat, posocznica, paraproteinemia.
W przypadku wystąpienia zaburzenia czynności nerek należy rozważyć przerwanie podawania dożylnych produktów immunoglobulin.
Chociaż doniesienia o zaburzeniu czynności nerek i ostrej niewydolności nerek odnotowuje się podczas stosowania wielu dopuszczonych do obrotu dożylnych immunoglobulin, zawierających różne substancje pomocnicze takie jak sacharozę, glukozę i maltozę, znacznie częściej zdarza się to po zastosowaniu produktów zawierających sacharozę, jako stabilizator. U pacjentów z grup ryzyka można rozważać użycie produktów, które nie zawierają sacharozy.
GAMMAGARD S/D nie zawiera sacharozy ani maltozy.
U pacjentów z ryzykiem wystąpienia ostrej niewydolności nerek, IVIg powinny być podawane
z minimalną szybkością wlewu i w najmniejszej stosowanej dawce.
Ostre poprzetoczeniowe uszkodzenie płuc
U pacjentów otrzymujących IVIg notowano niekardiogenny obrzęk płuc (ostre poprzetoczeniowe uszkodzenie płuc — ang. Transfusion Related Acute Lung Injury, TRALI).
Aseptyczne zapalenie opon mózgowych
W związku z terapią IVIg (w tym produktem leczniczym Gammagard S/D) zgłaszano zespół aseptycznego zapalenia opon mózgowych (ang. aseptic meningitis syndrome, AMS). Przerwanie terapii produktem IVIg może powodować remisję AMS w ciągu kilku dni bez następstw. Zespół z reguły rozpoczynał się w ciągu od kilku godzin do 2 dni po terapii produktem IVIg.
Dodatkowe ostrzeżenia:
Gammagard S/D zawiera przeciwciała grup krwi, które mogą działać jak hemolizyny i indukować w warunkach in vivo powlekanie krwinek czerwonych immunoglobulinami. Może to powodować dodatnią bezpośrednią reakcję antyglobulinową (test Coombsa). Niedokrwistość hemolityczna może
rozwinąć się z opóźnieniem w konsekwencji leczenia produktem Gammagard S/D w związku ze zwiększoną sekwestracją czerwonych krwinek: zgłaszano ostrą hemolizę, związaną z hemolizą wewnątrznaczyniową.
Następujące czynniki ryzyka mogą by związane z występowaniem hemolizy: duże dawki (pojedyncze
podanie lub dawka podzielona na kilka dni) oraz grupa krwi inna niż grupa ,,0”.
U pojedynczych pacjentów występowanie stanu zapalnego może zwiększać ryzyko hemolizy, ale jego
rola w tym procesie nie jest pewna.
Hiperproteinemia
U pacjentów otrzymujących leczenie produktem IVIg może pojawić się hiperproteinemia oraz
zwiększona lepkość surowicy.
Podaż sodu
Ilość sodu w maksymalnej dziennej dawce może wymiernie zwiększyć dzienną dopuszczalną dawkę
sodu w diecie u pacjentów na diecie niskosodowej. U tych pacjentów, ilość sodu pochodzącą
z produktu należy obliczyć i wziąć po uwagę określając ilość przyjmowanego sodu w diecie.
GAMMAGARD S/D zawiera 0,85% NaCl tj. około 3340 mg sodu w litrze 5% roztworu. Pacjent
o wadze 70 kg przyjmujący dawkę 1g/kg mc. (1,4 l) otrzymałby 4 676 mg sodu.
Przenoszenie czynników zakaźnych
GAMMAGARD S/D wytwarzany jest z ludzkiego osocza. Standardowe działania w celu zapobiegania zakażeniom w związku ze stosowaniem produktów leczniczych przygotowywanych z ludzkiej krwi lub osocza obejmują selekcję dawców, badania przesiewowe poszczególnych pobranych próbek bądź całych pul osocza w kierunku swoistych markerów zakażenia oraz wprowadzenie skutecznych etapów procesu produkcji w celu unieczynnienia / usunięcia wirusów. Pomimo to w przypadku podawania produktów leczniczych przygotowywanych z ludzkiej krwi lub osocza nie można całkowicie wykluczyć możliwości przeniesienia czynników zakaźnych. Odnosi się to również do nieznanych lub niedawno wykrytych wirusów oraz innych patogenów, takich jak patogen choroby Creutzfeldt-Jakoba (CJD).
Podejmowane środki uznawane są za skuteczne wobec wirusów osłonkowych, takich jak wirus nabytego niedoboru odporności (HIV), wirus zapalenia wątroby typu B (HBV) i wirus zapalenia wątroby typu C (HCV), a także wirusów bezosłonkowych wirus zapalenia wątroby typu A (HAV) i parwowirus B19.
Doświadczenia kliniczne przemawiają za brakiem przypadków transmisji wirusa zapalenia wątroby typu A czy parwowirusa B19 podczas podawania produktu immunoglobulin; przypuszcza się, że zawartość przeciwciał ma istotny udział w ochronie przeciwko tym wirusom.
Szczególnie zaleca się, aby po każdorazowym podaniu GAMMAGARD S/D odnotowywać nazwę
i numer serii produktu, w celu możliwości powiązania pacjenta z daną serią produktu.
Selektywny niedobór IgA
Immunoglobuliny IVIg nie są wskazane u pacjentów z selektywnym niedoborem IgA, u których
niedobór IgA stanowi jedyną nieprawidłowość.
Interakcje z testami serologicznymi
Po podaniu wlewu dożylnego immunoglobulin, przemijające zwiększenie poziomu we krwi różnorodnych biernie przeniesionych przeciwciał może skutkować fałszywie dodatnimi wynikami testów serologicznych, dotyczących np. WZW A, WZW B, odry i ospy wietrznej.
Bierna transmisja przeciwciał przeciwko antygenom erytrocytów, np. antygenom A, B, D, może zakłócać wyniki niektórych testów serologicznych w kierunku przeciwciał reagujących z krwinkami czerwonymi, na przykład testu antyglobulinowego (testu Coombs’a).
Podawanie ludzkich immunoglobulin może powodować fałszywie dodatnie wyniki oznaczania obecności beta-D-glukanów w surowicy w diagnostyce zakażeń grzybiczych; ten stan może się utrzymywać przez dłuższy czas po infuzji produktu.
Szczepionki zawierające żywe, atenuowane wirusy
Podanie ludzkich immunoglobulin może osłabiać immunogenność niektórych szczepionek zawierających żywe, atenuowane wirusy, takie jak wirusy odry, różyczki, świnki i ospy wietrznej przez okres od 6 tygodni nawet do 3 miesięcy. Szczepienie szczepionkami zawierającymi żywe, atenuowane wirusy powinno być zatem przeprowadzane dopiero po 3 miesiącach od ostatniego podania produktu GAMMAGARD S/D. W przypadku szczepionki przeciwko odrze skuteczność immunizacji może być osłabiona aż do roku. Dlatego też przed podaniem szczepionki przeciwko odrze należy sprawdzić u pacjenta poziom przeciwciał.
Dzieci i młodzież
Nie ma badań interakcji produktu leczniczego GAMMAGARD S/D prowadzonych w grupie dzieci i młodzieży.
Ciąża
Bezpieczeństwo stosowania GAMMAGARD S/D u kobiet w ciąży nie zostało ustalone w badaniach klinicznych i dlatego należy zachować ostrożność podczas podawania kobietom w ciąży i matkom karmiącym. Wykazano, że produkty IVIg podawane matce przenikają przez łożysko, co nasila się podczas trzeciego trymestru ciąży. Doświadczenie kliniczne ze stosowaniem immunoglobulin sugeruje, że nie należy oczekiwać szkodliwego wpływu na przebieg ciąży ani na płód i noworodka.
Karmienie piersią
Immunoglobuliny są wydzielane do mleka matek karmiących i mogą uczestniczyć w ochronie noworodków przed patogenami przedostającymi się przez błony śluzowe.
Płodność
Doświadczenie kliniczne z immunoglobulinami sugeruje, że nie należy oczekiwać ich szkodliwego wpływu na płodność.
Niektóre działania niepożądane związane z produktem GAMMAGARD S/D mogą pogarszać zdolność prowadzenia pojazdów i obsługiwania maszyn. Pacjenci doświadczający podczas leczenia działań niepożądanych powinni poczekać na ich ustąpienie przed rozpoczęciem prowadzenia pojazdów
i obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Podczas stosowania normalnej ludzkiej immunoglobuliny do podawania dożylnego sporadycznie mogą wystąpić takie objawy uboczne jak dreszcze, ból głowy, zawroty głowy, gorączka, wymioty, reakcje alergiczne, nudności, bóle stawów, obniżenie ciśnienia krwi oraz umiarkowany ból pleców.
Rzadko podanie normalnych ludzkich immunoglobulin może powodować nagły spadek ciśnienia krwi, a w pojedynczych przypadkach wstrząs anafilaktyczny, nawet jeśli pacjent nie wykazywał objawów nadwrażliwości w czasie poprzednich wlewów.
Podczas podawania immunoglobuliny ludzkiej normalnej obserwowano przypadki przemijającego jałowego zapalenia opon mózgowych i rzadkie przypadki przemijających reakcji skórnych (w tym tocznia rumieniowatego skórnego - częstość nieznana). Przemijające reakcje hemolityczne były
obserwowane szczególnie u pacjentów, którzy mieli grupę krwi A, B lub AB. Rzadko, po leczeniu dużymi dawkami IVIg rozwijała się niedokrwistość hemolityczna wymagająca przetoczenia krwi (patrz też punkt 4.4).
Obserwowano ponadto wzrost poziomu kreatyniny we krwi i (lub) ostrą niewydolność nerek.
Bardzo rzadko: Obserwowano reakcje zakrzepowo-zatorowe, takie jak zawał serca, udar, zatorowość płucna i zakrzepica żył głębokich.
Z doświadczenia klinicznego wynika, że podawanie dożylne ludzkich immunoglobulin może mieć związek z występowaniem stanów zakrzepowych. Ponieważ przyczyna tego nie jest znana, należy zachować szczególną ostrożność podczas przepisywania i podawania dożylnych immunoglobulin pacjentom, u których odnotowywano przypadki lub stwierdzono czynniki predysponujące do rozwoju choroby sercowo-naczyniowej i stanów zakrzepowych. Analiza raportów działań niepożądanych wykazała, że duża szybkość wlewu może być czynnikiem zwiększającym ryzyko zamknięcia światła naczyń.
Tabelaryczne podsumowanie działań niepożądanych
Tabele zbiorcze poniżej przedstawiają klasyfikację układów i narządów MedDRA (SOC - System Organ Class oraz zalecanej terminologii - Preferred Term Level).
Częstości występowania oceniano według następującej konwencji: bardzo często (≥ 1/10); często (≥ 1/100 do < 1/10); niezbyt często (≥ 1/1000 do < 1/100); rzadko (≥ 1/10 000 do < 1/1000); bardzo rzadko (< 1/10 000); częstość nieznana (nie może być określona na podstawie dostępnych danych).
W obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione
w kolejności zmniejszającego się nasilenia.
Działania niepożądane zgłoszone podczas badań klinicznych
Działania niepożądane zostały zgłoszone w kluczowym badaniu klinicznym z zastosowaniem produktu leczniczego GAMMAGARD S/D oraz z badania IV fazy, oceniającego ciężkość
i średnioterminowe bezpieczeństwo stosowania GAMMAGARD S/D.
Działania niepożądane zgłoszone w badaniach klinicznych po podaniu GAMMAGARD S/D | ||
Klasyfikacja układów i narządów MedDRA | Termin zalecany przez MedDRA (wersja 19.0) | Częstość działań niepożądanych* |
Zakażenia i zarażenia pasożytnicze | Grypa | Niezbyt często |
Zaburzenia metabolizmu i odżywiania | Zmniejszenie apetytu | Niezbyt często |
Zaburzenia psychiczne | Lęk, pobudzenie | Niezbyt często |
Zaburzenia układu nerwowego | Ból głowy | Często |
Letarg | Niezbyt często | |
Zaburzenia oka | Zamazane widzenie | Niezbyt często |
Zaburzenia serca | Przyspieszone bicie serca | Niezbyt często |
Zaburzenia naczyniowe | Zaczerwienienie twarzy | Często |
Wahania ciśnienia tętniczego krwi | Niezbyt często | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Duszność, krwawienie z nosa | Niezbyt często |
Zaburzenia żołądka i jelit | Wymioty, nudności | Często |
Biegunka, zapalenie jamy ustnej, ból górnej części brzucha, uczucie dyskomfortu w nadbrzuszu | Niezbyt często | |
Zaburzenia skóry i tkanki podskórnej | Pokrzywka, świąd, zimne poty, nadmierne pocenie się | Niezbyt często |
Działania niepożądane zgłoszone w badaniach klinicznych po podaniu GAMMAGARD S/D | ||
Klasyfikacja układów i narządów MedDRA | Termin zalecany przez MedDRA (wersja 19.0) | Częstość działań niepożądanych* |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Bóle pleców, kurcze mięśni, bóle kończyn | Niezbyt często |
Zaburzenia ogólne i stany w miejscu podania | Osłabienie, dreszcze, gorączka | Często |
Ból w klatce piersiowej, osłabienie, ból, uczucie dyskomfortu w klatce piersiowej, złe samopoczucie, uczucie zimna, uczucie gorąca, dolegliwości grypopodobne, rumień w miejscu podania produktu leczniczego, wynaczynienie w miejscu podania, ból w miejscu podania | Niezbyt często | |
Badania diagnostyczne | Podwyższone ciśnienie krwi | Niezbyt często |
*w przeliczeniu na wlew
Działania niepożądane zgłoszone po wprowadzeniu produktu leczniczego do obrotu
Następujące działania niepożądane zostały zgłoszone po wprowadzeniu produktu leczniczego do obrotu.
Zakażenia i zarażenia pasożytnicze: aseptyczne zapalenie opon mózgowych
Zaburzenia krwi i układu chłonnego: hemoliza, niedokrwistość, trombocytopenia, limfadenopatia
Zaburzenia układu immunologicznego: reakcja anafilaktyczna lub anafilaktoidalna, wstrząs
anafilaktyczny, nadwrażliwość
Zaburzenia układu nerwowego: incydent naczyniowo-mózgowy, przemijający napad niedokrwienny, drgawki, migrena, zawroty głowy, parestezje, omdlenie, drżenie, krwotok do ośrodkowego układu nerwowego
Zaburzenia psychiczne: niepokój
Zaburzenia oka: zakrzepica naczyń siatkówki, zaburzenie widzenia, ból oka, światłowstręt
Zaburzenia serca: zawał serca, sinica, tachykardia, bradykardia
Zaburzenia naczyniowe: zakrzepowe zapalenie żył, zakrzepica żyły głównej, zakrzepica żył głębokich, zakrzepica tętnic, niedociśnienie, nadciśnienie, bladość
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia: zatorowość płucna, obrzęk płuc,
niedotlenienie krwi, skurcz oskrzeli, świszczący oddech, hiperwentylacja, ucisk w gardle, kaszel
Zaburzenia żołądka i jelit: ból brzucha, niestrawność
Zaburzenia wątroby i dróg żółciowych: zapalenie wątroby (nieinfekcyjne zapalenie wątroby) Zaburzenia skóry i tkanki podskórnej: obrzęk naczynioruchowy, zapalenie skóry, rumień wysypka Zaburzenia mięśniowo szkieletowe i tkanki łącznej: bóle stawów, bóle mięśni
Zaburzenia nerek i układu moczowego: niewydolność nerek
Zaburzenia ogólne i stany w miejscu podania: reakcje w miejscu podania, osłabienie, obrzęk
Badania diagnostyczne: dodatni bezpośredni odczyn Coombsa
Informacje o bezpieczeństwie stosowania z uwagi na możliwość przenoszenia czynników
zakażających zamieszczono w punkcie 4.4.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181 C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
4.8 Przedawkowanie
Przedawkowanie może prowadzić do nadmiernego obciążenia ustroju płynami i wzrostu lepkości krwi, zwłaszcza u pacjentów z grup ryzyka, w tym osób w podeszłym wieku oraz pacjentów z niewydolnością serca lub nerek.
Grupa farmakoterapeutyczna: surowice odpornościowe i immunoglobuliny: immunoglobuliny,
normalne ludzkie, do podawania dożylnego, Kod ATC: J06BA02.
GAMMAGARD S/D zawiera głównie niezmienione funkcjonalnie cząsteczki immunoglobuliny G
(IgG) z szerokim zakresem przeciwciał przeciwko czynnikom zakaźnym.
GAMMAGARD S/D zawiera przeciwciała IgG obecne w normalnej populacji. Wytwarzany jest
z pulowanego osocza pochodzącego od co najmniej 1000 dawców. Skład podklas IgG w produkcie jest bardzo zbliżony do składu podklas IgG normalnego ludzkiego osocza. Odpowiednie dawki produktu mogą przywrócić obniżony poziom immunoglobulin G do wartości prawidłowych.
Mechanizm działania we wskazaniach innych niż leczenie substytucyjne nie jest w pełni wyjaśniony; przypuszcza się, że może mieć podłoże immunomodulacyjne.
GAMMAGARD S/D natychmiast po podaniu dożylnym osiąga pełną biodostępność w krążeniu pacjenta. Dosyć szybko ulega dystrybucji pomiędzy osoczem i płynem zewnątrznaczyniowym, po ok. 3-5 dniach ustala się stan równowagi pomiędzy przestrzenią wewnątrz- i zewnątrznaczyniową.
Okres półtrwania GAMMAGARD S/D wynosi ok. 37,7±15 dni. Okres ten może być różny
u poszczególnych pacjentów, szczególnie przy pierwotnych niedoborach immunologicznych.
Immunoglobuliny IgG i utworzone z IgG kompleksy ulegają degradacji w komórkach układu
siateczkowo-śródbłonkowego.
Immunoglobuliny są naturalnymi składnikami ludzkiego ciała.
Bezpieczeństwo stosowania GAMMAGARD S/D udowodnione zostało w badaniach nieklinicznych. Dane niekliniczne oparte na wynikach konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa stosowania oraz genotoksyczności nie wykazały szczególnego zagrożenia dla człowieka.
Doświadczenie kliniczne nie dostarcza dowodów możliwego działania rakotwórczego immunoglobulin, wobec powyższego nie przeprowadzano badań eksperymentalnych u gatunków heterogenicznych.
Proszek:
Albumina ludzka (0,06 g/g IgG)
Glicyna Sodu chlorek
Glukoza jednowodna
Rozpuszczalnik:
woda do wstrzykiwań
Nie wolno mieszać GAMMAGARD S/D z innymi produktami leczniczymi.
Zaleca się, aby GAMMAGARD S/D podawać osobno, w przypadku gdy pacjent przyjmuje
jednocześnie inne produkty lecznicze.
2 lata
Wykazano, że po rekonstytucji GAMMAGARD S/D zachowuje stabilność chemiczną i fizyczną przez 2 godziny w temperaturze pokojowej. Z mikrobiologicznego punktu widzenia produkt należy zużyć natychmiast. Za czas i sposób przechowywania do momentu podania odpowiada użytkownik produktu leczniczego, nie należy jednak przechowywać dłużej niż 24 godziny w temperaturze 2C - 8C, o ile roztwór sporządzono w kontrolowanych i zwalidowanych warunkach aseptycznych.
Przechowywać w temperaturze poniżej 25°C.
Nie zamrażać, fiolka z rozpuszczalnikiem może pęknąć.
Fiolki przechowywać w zewnętrznym opakowaniu kartonowym w celu ochrony przed światłem. Nie używać po terminie ważności.
Warunki przechowywania produktu po rekonstytucji, patrz punkt 6.3.
Fiolki z proszkiem i rozpuszczalnikiem do wszystkich dawek wykonane są ze szkła typu I. Fiolki z proszkiem i rozpuszczalnikiem zamknięte są korkami z gumy bromobutylowej, pokrytymi silikonem.
GAMMAGARD S/D dostępny jest w opakowaniach po 5,0 g i 10,0 g.
Każde opakowanie GAMMAGARD S/D 5,0 g i 10 g: zawiera fiolkę z 5,0 g lub 10 g proszku, fiolkę z rozpuszczalnikiem (odpowiednio 96 ml lub 192 ml wody do wstrzykiwań), przyrząd do przenoszenia, zestaw do podawania wyposażony w filtr.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Jeżeli sporządzanie roztworu odbywa się w warunkach aseptycznych poza komorą z nawiewem laminarnym, podawanie należy rozpocząć tak szybko jak to możliwe, ale nie później niż 2 godziny po sporządzeniu roztworu. Jeżeli sporządzanie roztworu odbywa się w warunkach aseptycznych
w komorze z nawiewem laminarnym, gotowy produkt można przechowywać w warunkach chłodniczych (2-8oC), do 24 godzin. Jeżeli warunki te nie są spełnione, sterylność rozpuszczonego produktu może nie być utrzymana. Fiolki z niezużytym roztworem należy wyrzucić.
Proszek powinien całkowicie rozpuścić się w ciągu 30 minut. Produkt przed podaniem należy ogrzać do temperatury pokojowej lub temperatury ciała.
Przed rekonstytucją, proszek powinien być białym lub bladożółtym proszkiem bez widocznych, obcych cząstek. Produkt po rekonstytucji należy ocenić wzrokowo przed podaniem pod kątem obecności cząstek stałych lub zmiany barwy. Roztwór powinien być klarowny lub lekko opalizujący i bezbarwny lub bladożółty. Nie należy stosować roztworów, które są mętne lub zawierają osad.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Rekonstytucja – stosować zasady aseptyki:
zestaw 5 g; 10 g
Uwaga: Wkłucie ostrza poza środek korka może spowodować przemieszczenie korka
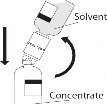
i utratę próżni.
zestaw 5 g; 10 g
Podać roztwór zgodnie z instrukcją użycia załączoną do zestawu do podawania dożylnego, który znajduje się w każdym opakowaniu. W przypadku zastosowania innego zestawu należy upewnić się, czy zawiera on podobny filtr.
DOPUSZCZENIE DO OBROTU
Takeda Pharma Sp. z o.o. ul. Prosta 68
00-838 Warszawa
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 22 marca 1988 r.
Data ostatniego przedłużenia pozwolenia: 09 lipca 2013 r.











