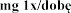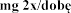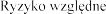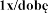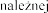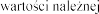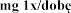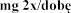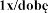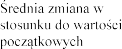Spis treści:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
1. NAZWA PRODUKTU LECZNICZEGO
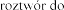
Pulmozyme, 1 mg/ml, nebulizacji
2. 
Dornasum alfa
000
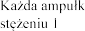

a zawiera 2 500 U (2,5 mg) dornazy alfa (rh DNaza) w 2,5 ml roztworu, co odpowiada U/ml (1 mg/ml; 1 jednostka Genentech/ml = 1 g/ml).
Dornaza alfa jest to 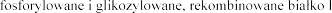 udzkiej
udzkiej
dezoksyrybonukleazy 1.
 , patrz punkt 6.1.
, patrz punkt 6.1.
3. 
R nebulizacji.
J klarowny i bezbarwny  o pH 6,3.
o pH 6,3.
4.  E
E
4.1 Wskazania do stosowania
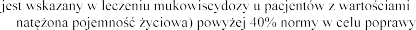
Produkt leczniczy Pulmozyme FVC (ang. forced vital capacity -
4.2
Dawkowanie
Zalecana dawka wynosi 2 500 U (2,5 mg) dezoksyrybonukleazy 1 w postaci inhalacji, raz .
Inhalacj
(patrz punkt 6.6).

ml roztworu) przy
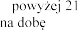
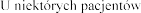 w wieku lat
w wieku lat 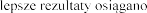 podczas stosowania produktu leczniczego dwa razy .
podczas stosowania produktu leczniczego dwa razy .
U w
najlepsz
podczas regularnego, codziennego
stosowania produktu leczniczego Pulmozyme
ybko zanika po odstawieniu
produktu leczniczego produkt leczniczy codziennie.
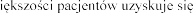
fiz

leczniczego Pulmozyme
oddechowego, podawanie produktu
Dotychczas nie ustalono profilu


stosowania 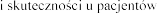 , h
, h
Stosowanie u dzieci
Il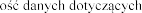 stosowania produktu leczniczego Pulmozyme u dzieci w wieku
stosowania produktu leczniczego Pulmozyme u dzieci w wieku 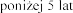 jest ograniczona.
jest ograniczona.
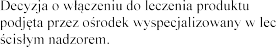
leczniczego 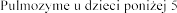 lat
lat 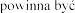
zeniu mukowiscydozy, a terapia prowadzona pod
wania
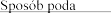
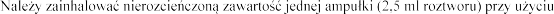
zalecanego inhalatora (patrz punkt 6.6).
4.3 Przeciwwskazania
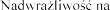
su lub na
lub na 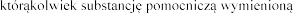
w punkcie 6.1.

4.4
W celu poprawy identyfikacji stosowania biologicznych 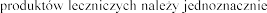 zapis
zapis oraz numer serii stosowanego leku w dokumentacji medycznej pacjenta.
oraz numer serii stosowanego leku w dokumentacji medycznej pacjenta.
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Pulmozyme skojarzeniu ze standardowymi lekami podawanymi w mukowiscydozi trzustkowe, witaminy,
4.6  i laktacj
i laktacj
stosowania do
przeprowadzone na zwierz tach
szkodliwego
na oraz zarodka i (patrz punkt 5.3). w przypadku przepisywania produktu leczniczego

W przypadku stosowania dornazy alfa u ludzi, zgodnie z zaleconym dawkowaniem,
jedynie w minimalnym stopniu. Dlatego w
mleku matki. N jednak podczas stosowania dornazy alfa u kobiet (patrz punkt 5.2 i punkt 5.3).
4.7  maszyn
maszyn
Pulmozyme 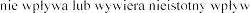 na prowadzenia
na prowadzenia 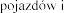
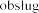 iwania maszyn.
iwania maszyn.
4.8 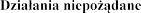
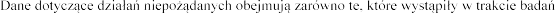
klinicznych, jak i po wprowadzeniu produktu leczniczego Pulmozyme do obrotu, stosowanego w zalecanych dawkach.
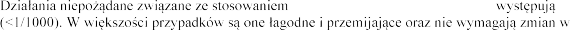
produktu leczniczego Pulmozyme rzadko
schemacie dawkowania produktu leczniczego Pulmozyme.
Zaburzenia oka:
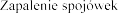
.
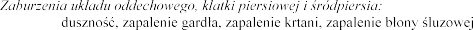
Dysfonia, nosa (wszystkie
pochodzenia nieinfekcyjnego).
Badania diagnostyczne:
Pogorszenie 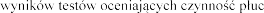 .
.
.
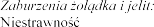
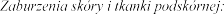
Wysypka, pokrzywka.
 .
.
produktu leczniczego Pulmozyme, na co wskazuje wysoki odsetek z li badania kliniczne z produktem leczniczym Pulmozyme.
, u nielicznych
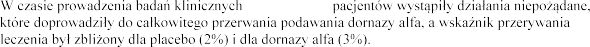
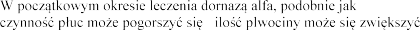
w przypadku stosowania innych aerozoli,
i .
ania przeciwko niej przeciwko dornazie alfa.
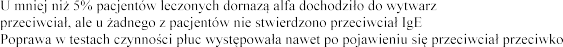
dornazie alfa.
produktu leczniczego Pulmozyme w codziennej inhalacji
przez 2
do 10 lat. Liczba pacj grupie wiekowej w
wy
starszej grupy wiekowej
nasilenie
L
tak
jak i
Rodzaj
z produktem leczniczym Pulmozyme, w
.


produktu leczniczego do obrotu i prospektywnie
produktu leczniczego opisywane w badaniach klinicznych.
produktu lecznic
:
Departamentu
Al. Jerozolimskie 181C 02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
4.9 Przedawkowanie
nemu.
produktu leczniczego Pulmozyme.
W badaniach klinicznych p leczniczego
produktu zalecana dawka dobowa) przez
tygodnie podawania produktu leczniczego/2 tygodnie
mc.
mc.


produktu leczniczego Pulmozyme nie powinna
ornazy alfa
w surowicy. Z tego powodu w przypadku przedawkowania produktu leczniczego raczej nie powinno
 (patrz punkt 5.2).
(patrz punkt 5.2).
5. 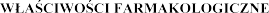
5.1
Grupa farmakoterapeutyczna: Leki mukolityczne, kod ATC: R05 CB13

Zaleganie lepkiej, ropnej wydzieliny
w od
In vitro dornaza alfa hydrolizuje DNA zawarte w plwocinie i znacznie
Dane kliniczne
Oceniano stosowanie produktu leczniczego
uznane za konieczne przez lekarza.
Wyniki
, kontrolowanych
e. cznie
19
W innym kontrolowanym produktu leczniczego Pulmo
FVC
leczniczy Pulmozyme w dawce 2,5 mg raz lub dwa razy na przydzielono losowo
78%.
ym badaniu (Z0713) ocenian
Do badania przydzielono losowo FVC 102,3%.


produktem leczniczym Pulmozyme obserwowano istotne
FEV1 w
istotna. Produkt leczniczy
podawania antybio 1 mierzonego w pierwszych
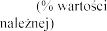
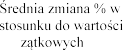
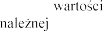
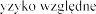
tygodniach leczenia.
Badania Z0342/Z0343 | Placebo N = 325 | 2,5 N = 322 | 2,5 N = 321 | |
FEV1 | poc | |||
- 0,5% | 7,9% | 9,0% | ||
| 0,1% | 5,1% | 3,6% | |
Sumarycznie | 0,0% | 5,8% | 5,6% | |
p < 0,001 | p < 0,001 | |||
po | 43% | 34% | 33% | |
% pa |
| |||
zaostrzeniami | (95% CI) | 0,73 (0,57 0,94) | 0,71 (0,55 0,91) | |
p = 0,015 | p = 0,007 | |||
Badanie Z0713 | Placebo N = 235 | 2,5 mg N = 237 | ||
Spirometria |
| |||
(w Tygodniu 96) | ||||
FEV1 (% | ||||
| - 3,10 | 0,03 | ||
p = 0,008 | ||||
FVC (% | ||||
) | - 2,88 | - 2,23 | ||
p = 0,54 | ||||
FEF 25-75 (% | ||||
| ) | - 4,05 | 3,83 | |
p = 0,0008 | ||||
| 24% | 17% | ||
% pa | R | |||
zaostrzeniami | (95% CI) | 0,66 (0,44 - 0,996) | ||
p = 0,048 | ||||
Podawanie produktu Pulmozyme w dawce 2,5 mg raz lub dwa razy na Hudson T Up-draft II z kompresorem Pulmo-
nebulizatora
V1
Wyniki analizy danych post-hoc sugeruj
produktu leczniczego Pulmozyme na zaostrzenia

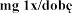
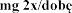
placebo oraz 48% i 39% dla produktu leczniczego Pulmozyme 2,5 mg podawanego, odpowiednio, raz
(patrz tabela
).
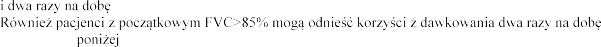
poza
Placebo n = 325
2,5
2,5
n = 322
n = 321
44% (203)
14% (118)
41% (201)
21% (121)
54%
(194)
27%
(131)
40%
28% (184)
39% (137)
25% (199)
48% (123)
42%
(201)
44%
(124)
Wiek
5-20 lat
21
(n)
(n)
2,5
2,5
Placebo (n)
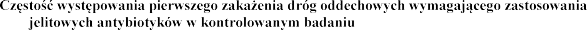






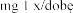
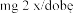



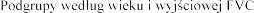












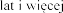
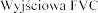






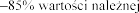
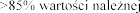
Stosowanie produkt
ie zmiany
w
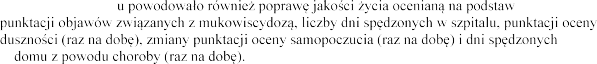

Pacjenci z FVC pon
produktem Pulmozyme
w dawce 2,5 mg raz 1 i FVC w tej
1 i
produkt Pulmozyme wobec 2,1% i 7,3%
w grupie placebo (p <0
dwa razy n
1
badania, gdy wszyscy pacjenci otrzymywali produkt Pulmozyme w dawce 2,5 mg
w
retrospektywnie na jedynie 40%.

j 5 lat
dostarczenie DNazy w podobnym u za
produktu Pulmozyme za
Boy) powoduje
produktu Pulmozyme.
4.8.
Nie przep
5.2
oustrojowego dornazy alfa po podaniu wziewnym
naczelnych. Zgodnie z wynikami , dornaza alfa podawana pacjentom w postaci aerozolu inhalacyjnego wykazuje niewielk .
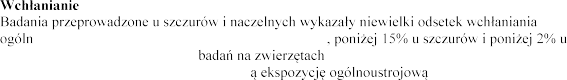

minimalne.
W warunkach fizjologicznych dezoksyrybonukleaz 40 mg dornazy alfa przez okres do 6 dni nie dezoksyrybonukleaz
go
10 ng/ml. Po podaniu 2,5 mg dornazy alfa dwa razy na dezoksyrybonukleazy w surowic
0,1
oustrojowe organizmie.
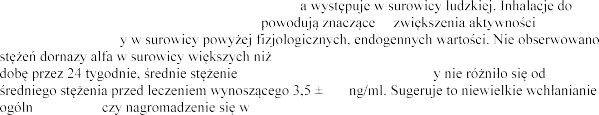
Dystrybucja
Badania przeprowadzone

szybko usuwana z surowicy. W tych badaniach p
alfa
ornazy alfa w

Po inhalacji 2,5 mg dornazy plwocinie o 3
szybko po inhalacji.
Metabolizm
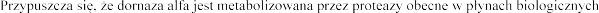
Wydalanie
Badania na szczurach i ma
rhDNaza ulega szybkiemu
4 godziny.
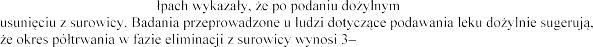
Badania na szczurach wyka
okres
ednak
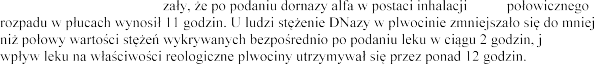
Populacja dzieci

Produkt leczniczy
2,5 <5 lat,
9 po podaniu
-p byli w stanie wykaza
enia DNazy w
grupie wiekowej od 5 do 9 lat.
a standardowe odchylenie)
w grupie wiekowej od 3 <
G
41%

5.3 Przedklini
Dane niekliniczne | bada farmakologicznych | ych |
, | po podaniu wielokrotnym | lnej |
i toksyczn | , | |
. |
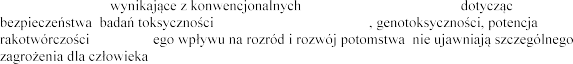
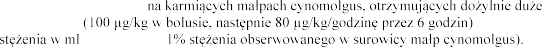
W badaniu przeprowadzonym
dawki dornazy alfa , wykryto jej

e eku matki (<0,
podawanie leku rozpoczynano po 22 dniach od porodu, w dawkach 0, 51, 102 i 260
oddechowych.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Okres
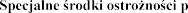 odczas przechowywania
odczas przechowywania d
d e usuwania i przygotowania produktu leczniczego do stosowania
e usuwania i przygotowania produktu leczniczego do stosowania
Sodu chlorek
Wapnia chlorek dwuwodny W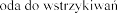
2 lata.
C
.
p
torebkach z folii, w oryginalnym opakowaniu
w celu
Jednorazowa
produktu.

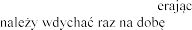
Z jednej 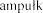 i (2,5 mg, czyli 2500 U) do jednorazowego podania, zawi ej
i (2,5 mg, czyli 2500 U) do jednorazowego podania, zawi ej 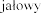 produktu leczniczego Pulmozyme do inhalacji, z zastosowaniem
produktu leczniczego Pulmozyme do inhalacji, z zastosowaniem
odpowiedniego typu nebulizatora.
Produktu leczniczego Pulmozyme nie  miesza z innymi lekami ani z roztworami w komorze nebulizatora (patrz punkt 6.2).
miesza z innymi lekami ani z roztworami w komorze nebulizatora (patrz punkt 6.2).
 umie w komorze nebulizatora, takiego jak: Hudson T Up-draft II/Pulmo-Aide, Airlife Misty/Pulmo-Aide, Respirgard/Pulmo-Aide lub Acorn II/Pulmo-Aide.
umie w komorze nebulizatora, takiego jak: Hudson T Up-draft II/Pulmo-Aide, Airlife Misty/Pulmo-Aide, Respirgard/Pulmo-Aide lub Acorn II/Pulmo-Aide.
Pulmozyme  , np. Pari
, np. Pari
LL/Inhalierboy, Pari LC/Inhalierboy lub Master, Pari Baby, Aiolos/2 Aiolos, Side Stream/CR50 lub MobilAire lub Porta-Neb.

nebulizator Pari eRAPID elektroniczny nebulizator powszechnego
.
nebulizacji, nebulizatora
produktu leczniczego
Pulmozyme,

stosowa .
Zabezpieczenie aerozolu nie jest konieczne.
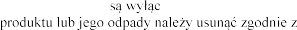
z produktem leczniczym Pulmozyme przeznaczone znie do jednorazowego
. Wszelkie niewykorzystane resztki lokalnymi przepisami.
7. 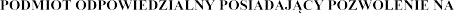 DOPUSZCZENIE DO OBROTU
DOPUSZCZENIE DO OBROTU
Roche Polska Sp. z o.o. ul. Domaniewska 28
02-672 Warszawa, Polska
Tel. +48 22 345 1888
Fax +48 22 345 1874
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I
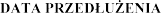 POZWOLENIA
POZWOLENIACHARAKTERYSTYKA PRODUKTU LECZNICZEGO
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Okres
lata.
R/3758
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 19 grudnia 1995 r.
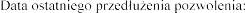 22 grudnia 2010 r.
22 grudnia 2010 r.
1. NAZWA PRODUKTU LECZNICZEGO
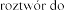
Pulmozyme, 1 mg/ml, nebulizacji
2. 
Dornasum alfa
000
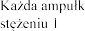

a zawiera 2 500 U (2,5 mg) dornazy alfa (rh DNaza) w 2,5 ml roztworu, co odpowiada U/ml (1 mg/ml; 1 jednostka Genentech/ml = 1 g/ml).
Dornaza alfa jest to 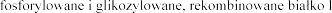 udzkiej
udzkiej
dezoksyrybonukleazy 1.
 , patrz punkt 6.1.
, patrz punkt 6.1.
3. 
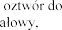
R nebulizacji.
J klarowny i bezbarwny 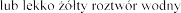 o pH 6,3.
o pH 6,3.
4.  E
E
4.1 Wskazania do stosowania
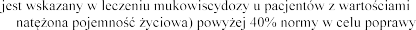
Produkt leczniczy Pulmozyme FVC (ang. forced vital capacity -
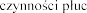
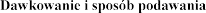
4.2
Dawkowanie
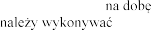
Zalecana dawka wynosi 2 500 U (2,5 mg) dezoksyrybonukleazy 1 w postaci inhalacji, raz .
Inhalacj
(patrz punkt 6.6).

ml roztworu) przy
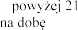
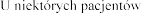 w wieku lat
w wieku lat 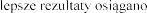 podczas stosowania produktu leczniczego dwa razy .
podczas stosowania produktu leczniczego dwa razy .
U w
najlepsz
podczas regularnego, codziennego
stosowania produktu leczniczego Pulmozyme
ybko zanika po odstawieniu
produktu leczniczego produkt leczniczy codziennie.
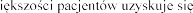
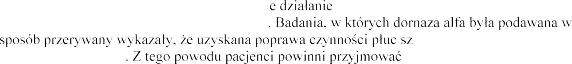
fiz

leczniczego Pulmozyme
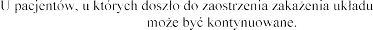
oddechowego, podawanie produktu
Dotychczas nie ustalono profilu
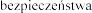


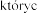
stosowania 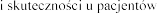 , h
, h
Stosowanie u dzieci
Il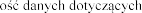 stosowania produktu leczniczego Pulmozyme u dzieci w wieku
stosowania produktu leczniczego Pulmozyme u dzieci w wieku 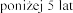 jest ograniczona.
jest ograniczona.
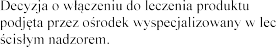
leczniczego 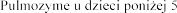 lat
lat 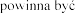
zeniu mukowiscydozy, a terapia prowadzona pod
wania
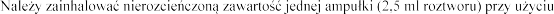
zalecanego inhalatora (patrz punkt 6.6).
4.3 Przeciwwskazania
su lub na
lub na 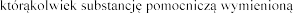
w punkcie 6.1.

4.4
W celu poprawy identyfikacji stosowania biologicznych 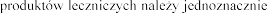 zapis
zapis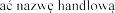 oraz numer serii stosowanego leku w dokumentacji medycznej pacjenta.
oraz numer serii stosowanego leku w dokumentacji medycznej pacjenta.
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
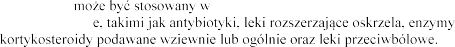
Pulmozyme skojarzeniu ze standardowymi lekami podawanymi w mukowiscydozi trzustkowe, witaminy,
4.6 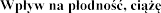 i laktacj
i laktacj
stosowania do
przeprowadzone na zwierz tach
szkodliwego
na oraz zarodka i (patrz punkt 5.3). w przypadku przepisywania produktu leczniczego
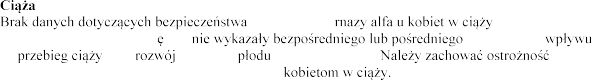

W przypadku stosowania dornazy alfa u ludzi, zgodnie z zaleconym dawkowaniem,
jedynie w minimalnym stopniu. Dlatego w
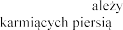
mleku matki. N jednak podczas stosowania dornazy alfa u kobiet (patrz punkt 5.2 i punkt 5.3).
4.7 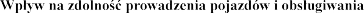 maszyn
maszyn
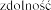
Pulmozyme 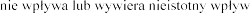 na prowadzenia
na prowadzenia 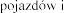
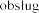 iwania maszyn.
iwania maszyn.
4.8 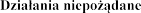
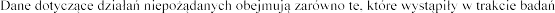
klinicznych, jak i po wprowadzeniu produktu leczniczego Pulmozyme do obrotu, stosowanego w zalecanych dawkach.
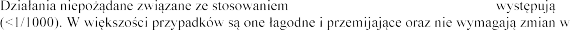
produktu leczniczego Pulmozyme rzadko
schemacie dawkowania produktu leczniczego Pulmozyme.
Zaburzenia oka:
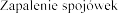
.
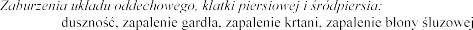
Dysfonia, nosa (wszystkie
pochodzenia nieinfekcyjnego).
Badania diagnostyczne:
Pogorszenie 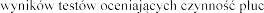 .
.
.
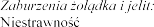
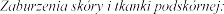
Wysypka, pokrzywka.
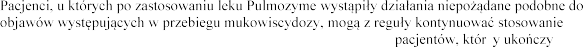
 .
.
produktu leczniczego Pulmozyme, na co wskazuje wysoki odsetek z li badania kliniczne z produktem leczniczym Pulmozyme.
, u nielicznych
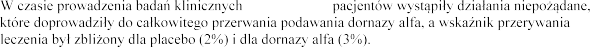
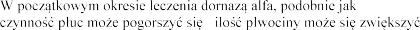
w przypadku stosowania innych aerozoli,
i .
ania przeciwko niej przeciwko dornazie alfa.
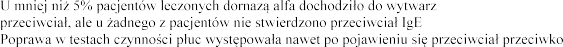
dornazie alfa.
produktu leczniczego Pulmozyme w codziennej inhalacji
przez 2
do 10 lat. Liczba pacj grupie wiekowej w
wy
starszej grupy wiekowej
nasilenie
L
tak
jak i
Rodzaj
z produktem leczniczym Pulmozyme, w
.


produktu leczniczego do obrotu i prospektywnie
produktu leczniczego opisywane w badaniach klinicznych.
produktu lecznic
:

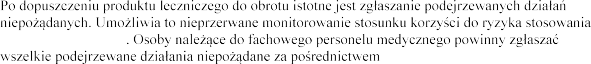
Departamentu
Al. Jerozolimskie 181C 02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
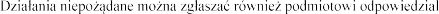
4.9 Przedawkowanie
nemu.
produktu leczniczego Pulmozyme.
W badaniach klinicznych p leczniczego
produktu zalecana dawka dobowa) przez
tygodnie podawania produktu leczniczego/2 tygodnie
mc.
mc.


produktu leczniczego Pulmozyme nie powinna
ornazy alfa
w surowicy. Z tego powodu w przypadku przedawkowania produktu leczniczego raczej nie powinno
 (patrz punkt 5.2).
(patrz punkt 5.2).
5. 

5.1
Grupa farmakoterapeutyczna: Leki mukolityczne, kod ATC: R05 CB13
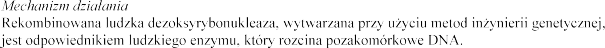
Zaleganie lepkiej, ropnej wydzieliny
w od
In vitro dornaza alfa hydrolizuje DNA zawarte w plwocinie i znacznie
Dane kliniczne
Oceniano stosowanie produktu leczniczego
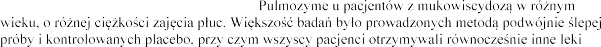
uznane za konieczne przez lekarza.
Wyniki
, kontrolowanych
e. cznie
19
W innym kontrolowanym produktu leczniczego Pulmo
FVC
leczniczy Pulmozyme w dawce 2,5 mg raz lub dwa razy na przydzielono losowo
78%.
ym badaniu (Z0713) ocenian
Do badania przydzielono losowo FVC 102,3%.


produktem leczniczym Pulmozyme obserwowano istotne
FEV1 w
istotna. Produkt leczniczy
podawania antybio 1 mierzonego w pierwszych
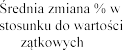
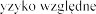
tygodniach leczenia.
Badania Z0342/Z0343 | Placebo N = 325 | 2,5 N = 322 | 2,5 N = 321 | |
FEV1 | poc | |||
- 0,5% | 7,9% | 9,0% | ||
| 0,1% | 5,1% | 3,6% | |
Sumarycznie | 0,0% | 5,8% | 5,6% | |
p < 0,001 | p < 0,001 | |||
po | 43% | 34% | 33% | |
% pa |
| |||
zaostrzeniami | (95% CI) | 0,73 (0,57 0,94) | 0,71 (0,55 0,91) | |
p = 0,015 | p = 0,007 | |||
Badanie Z0713 | Placebo N = 235 | 2,5 mg N = 237 | ||
Spirometria |
| |||
(w Tygodniu 96) | ||||
FEV1 (% | ||||
| - 3,10 | 0,03 | ||
p = 0,008 | ||||
FVC (% | ||||
) | - 2,88 | - 2,23 | ||
p = 0,54 | ||||
FEF 25-75 (% | ||||
| ) | - 4,05 | 3,83 | |
p = 0,0008 | ||||
| 24% | 17% | ||
% pa | R | |||
zaostrzeniami | (95% CI) | 0,66 (0,44 - 0,996) | ||
p = 0,048 | ||||
Podawanie produktu Pulmozyme w dawce 2,5 mg raz lub dwa razy na Hudson T Up-draft II z kompresorem Pulmo-
nebulizatora
V1
Wyniki analizy danych post-hoc sugeruj
produktu leczniczego Pulmozyme na zaostrzenia

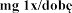
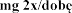
placebo oraz 48% i 39% dla produktu leczniczego Pulmozyme 2,5 mg podawanego, odpowiednio, raz
(patrz tabela
).
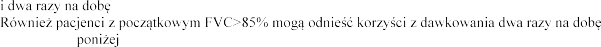
poza
Placebo n = 325
2,5
2,5
n = 322
n = 321
44% (203)
14% (118)
41% (201)
21% (121)
54%
(194)
27%
(131)
40%
28% (184)
39% (137)
25% (199)
48% (123)
42%
(201)
44%
(124)
Wiek
5-20 lat
21
(n)
(n)
2,5
2,5
Placebo (n)
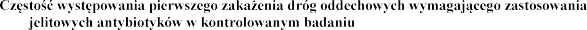






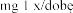
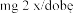
















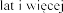
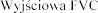






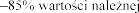
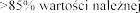
Stosowanie produkt
ie zmiany
w

Pacjenci z FVC pon
produktem Pulmozyme
w dawce 2,5 mg raz 1 i FVC w tej
1 i
produkt Pulmozyme wobec 2,1% i 7,3%
w grupie placebo (p <0
dwa razy n
1
badania, gdy wszyscy pacjenci otrzymywali produkt Pulmozyme w dawce 2,5 mg
w
retrospektywnie na jedynie 40%.

j 5 lat
dostarczenie DNazy w podobnym u za
produktu Pulmozyme za
Boy) powoduje
produktu Pulmozyme.
4.8.
Nie przep

5.2
oustrojowego dornazy alfa po podaniu wziewnym
naczelnych. Zgodnie z wynikami , dornaza alfa podawana pacjentom w postaci aerozolu inhalacyjnego wykazuje niewielk .
minimalne.
W warunkach fizjologicznych dezoksyrybonukleaz 40 mg dornazy alfa przez okres do 6 dni nie dezoksyrybonukleaz
go
10 ng/ml. Po podaniu 2,5 mg dornazy alfa dwa razy na dezoksyrybonukleazy w surowic
0,1
oustrojowe organizmie.
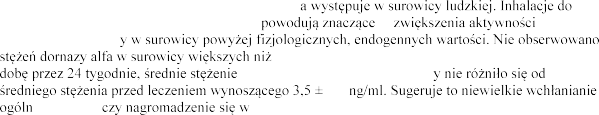
Dystrybucja
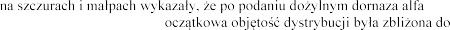
Badania przeprowadzone

szybko usuwana z surowicy. W tych badaniach p
alfa
ornazy alfa w
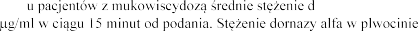
Po inhalacji 2,5 mg dornazy plwocinie o 3
szybko po inhalacji.
Metabolizm

Wydalanie
Badania na szczurach i ma
rhDNaza ulega szybkiemu
4 godziny.
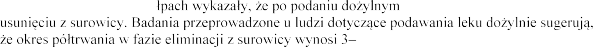
Badania na szczurach wyka
okres
ednak
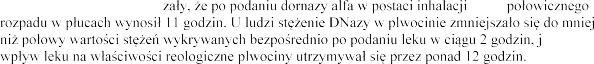
Populacja dzieci

Produkt leczniczy
2,5 <5 lat,
9 po podaniu
-p byli w stanie wykaza
enia DNazy w
grupie wiekowej od 5 do 9 lat.
a standardowe odchylenie)
w grupie wiekowej od 3 <
G
41%
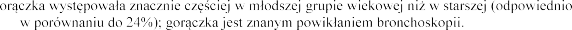

5.3 Przedklini
Dane niekliniczne | bada farmakologicznych | ych |
, | po podaniu wielokrotnym | lnej |
i toksyczn | , | |
. |

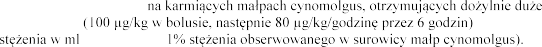
W badaniu przeprowadzonym
dawki dornazy alfa , wykryto jej

e eku matki (<0,
podawanie leku rozpoczynano po 22 dniach od porodu, w dawkach 0, 51, 102 i 260
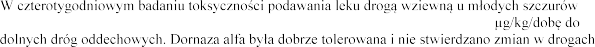
oddechowych.
Sodu chlorek
Wapnia chlorek dwuwodny W
 odczas przechowywania
odczas przechowywania d
d e usuwania i przygotowania produktu leczniczego do stosowania
e usuwania i przygotowania produktu leczniczego do stosowania
C
.
p
torebkach z folii, w oryginalnym opakowaniu
w celu
Jednorazowa
produktu.

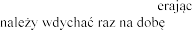
Z jednej 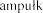 i (2,5 mg, czyli 2500 U) do jednorazowego podania, zawi ej
i (2,5 mg, czyli 2500 U) do jednorazowego podania, zawi ej 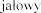 produktu leczniczego Pulmozyme do inhalacji, z zastosowaniem
produktu leczniczego Pulmozyme do inhalacji, z zastosowaniem
odpowiedniego typu nebulizatora.
Produktu leczniczego Pulmozyme nie  miesza z innymi lekami ani z roztworami w komorze nebulizatora (patrz punkt 6.2).
miesza z innymi lekami ani z roztworami w komorze nebulizatora (patrz punkt 6.2).
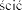
 umie w komorze nebulizatora, takiego jak: Hudson T Up-draft II/Pulmo-Aide, Airlife Misty/Pulmo-Aide, Respirgard/Pulmo-Aide lub Acorn II/Pulmo-Aide.
umie w komorze nebulizatora, takiego jak: Hudson T Up-draft II/Pulmo-Aide, Airlife Misty/Pulmo-Aide, Respirgard/Pulmo-Aide lub Acorn II/Pulmo-Aide.
Pulmozyme  , np. Pari
, np. Pari
LL/Inhalierboy, Pari LC/Inhalierboy lub Master, Pari Baby, Aiolos/2 Aiolos, Side Stream/CR50 lub MobilAire lub Porta-Neb.

nebulizator Pari eRAPID elektroniczny nebulizator powszechnego
.
nebulizacji, nebulizatora
produktu leczniczego
Pulmozyme,

stosowa .
Zabezpieczenie aerozolu nie jest konieczne.
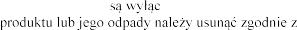
z produktem leczniczym Pulmozyme przeznaczone znie do jednorazowego
. Wszelkie niewykorzystane resztki lokalnymi przepisami.
7. 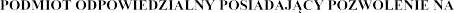 DOPUSZCZENIE DO OBROTU
DOPUSZCZENIE DO OBROTU
Roche Polska Sp. z o.o. ul. Domaniewska 28
02-672 Warszawa, Polska
Tel. +48 22 345 1888
Fax +48 22 345 1874
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I
 POZWOLENIA
POZWOLENIA CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
R/3758
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 19 grudnia 1995 r.
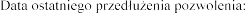 22 grudnia 2010 r.
22 grudnia 2010 r.
1 stycznia 2023