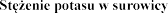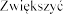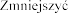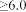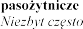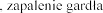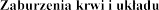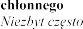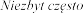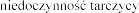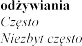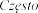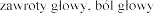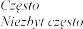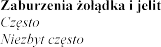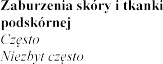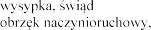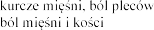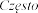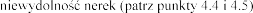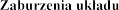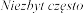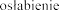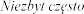Spis treści:
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
1. NAZWA PRODUKTU LECZNICZEGO
Espiro, 25 mg, tabletki powlekane Espiro, 50 mg, tabletki powlekane
2. 

Espiro 25 mg: mg eplerenonu.
Espiro 50 mg: mg eplerenonu.

laktoza jednowodna.
Espiro 25 mg: mg laktozy jednowodnej.
Espiro 50 mg: mg laktozy jednowodnej.

3. 
Tabletka powlekana.
Espiro 25
Espiro 50
mm.
mm.
w

4. 
4.1 Wskazania do stosowania
Eplerenon jest wskazany jako:
terapia dodana
u
-
z przyczyn sercowo-naczyniowych
[frakcja

przebytym niedawno zawale serca
i
-naczyniowych u do
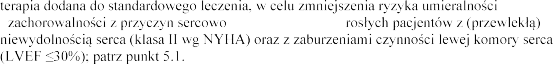
4.2
Dawkowanie

tabletki
dawki 25
-14 dni
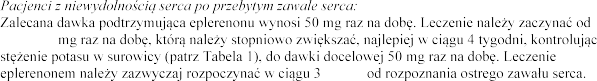
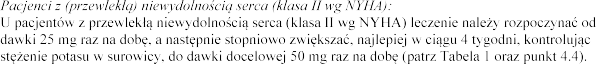
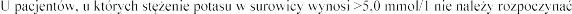
leczenia eplerenonem (patrz punkt 4.3).
pierwszego tygodnia leczenia i
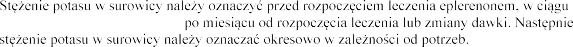
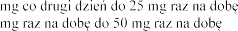
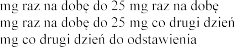
z danymi z Tabeli 1.
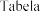
(mmol/l) | Dostosowanie dawki | |
<5,0 |
| 25 25 |
5,0-5,4 | Bez zmiany dawki | |
5,5-5,9 |
| 50 25 25 |
|
| Nie dotyczy |
Po odstawieniu eplerenonu
mmol/1.
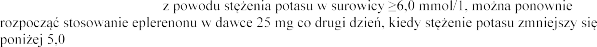
i

Pacjenci wieku
do umiarkowanej ni
w surowicy (patrz punkt 4.4).
N
nerek
ia potasu w surowicy (patrz punkt 4.4) oraz dostosowanie
-

4.4).
przebytym zawale serca. Podczas stosowania eplere
<
z klirensem kreatyniny
 /min) jest przeciwwskazane (patrz punkt 4.3). Eplerenon nie ulega dializie.
/min) jest przeciwwskazane (patrz punkt 4.3). Eplerenon nie ulega dializie.
N
z
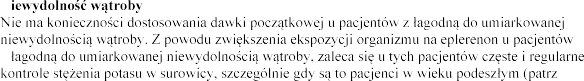
punkt 4.4).
Pacjenci
produkty lecznicze
np. amiodaronu, diltiazemu i werapamilu, leczenie
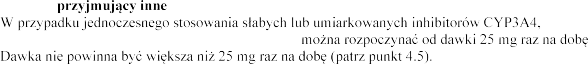
4.3 Przeciwwskazania
rz punkt 5.2).
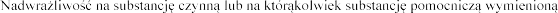
w punkcie 6.1
mmol/1
m2 (ang. estimated glomerular filtration rate - eGFR)
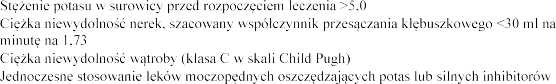
CYP3A4 (np. itrakonazol, ketokonazol, rytonawir, nelfinawir, klarytromycyna, telitromycyna i nefazodon) (patrz punkt 4.5)
Leczenie skojarzone inhibitorem konwertazy ang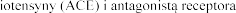 angiotensyny II (AIIRA) i eplerenonem.
angiotensyny II (AIIRA) i eplerenonem.

4.4
Hiperkaliemia
hiperkaliemii, takich jak pacjenci
w
, pacjenci
nie
potasu w

(lub) antagonistami
receptora an
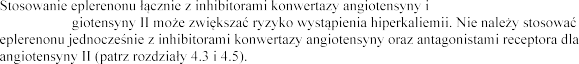
z
typu
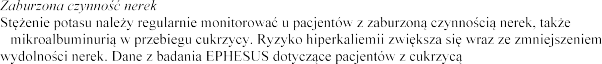
2 i
zachowaniem
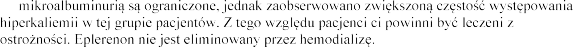
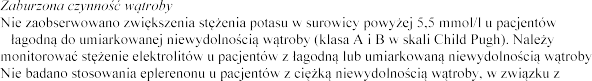
z
jest ono przeciwwskazane (patrz punkty 4.2 i 4.3).
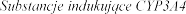
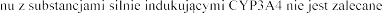
Jednoczesne stosowanie eplereno (patrz punkt 4.5).
czym
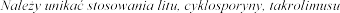
punkt 4.5).

Laktoza
podczas leczenia eplerenonem (patrz
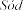
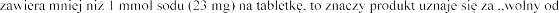
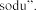
galaktozy. Espiro
brakiem -
4.5 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
asu
inne
i
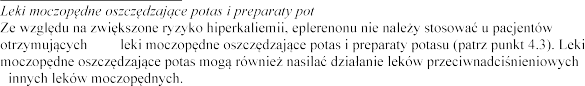
Interakcje farmakodynamiczne
receptora angiotensyny
eceptora angiotensyny II (AIIRA)

(lub) antagonistami
angiotensyny II i eplerenonu (patrz punkty 4.3 i 4.4).
Lit
, antagonisty receptora

Cyklosporyna, takrolimus
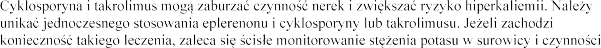
nerek (patrz punkt 4.4).
Niesteroidowe leki przeciwzapalne (NLPZ)
wieku i
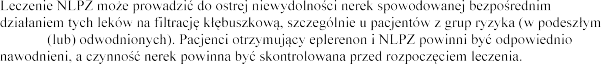
Trimetoprim
Jednoczesne stosowanie trimetoprimu z eplerenonem
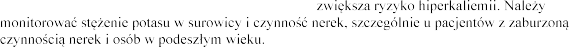
Alfa-1-adrenolityki (np. prazosyna, alfuzosyna)

Podczas jednoczesnego stosowania alfa-1-
eplerenonu i alfa-1- ortostatycznego.
i
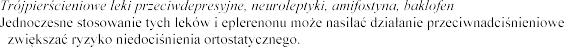
Glikokortykosteroidy, tetrakozaktyd
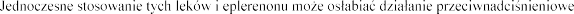
(zatrzymanie sodu i wody).
Interakcje farmakokinetyczne
Badania in vitro 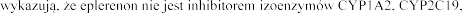
CYP2C9, CYP2D6 czy CYP3A4. Eplerenon nie jest substratem ani inhibitorem P-glikoproteiny.
Digoksyna
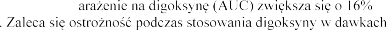
Podczas jednoczesnego stosowania eplerenonu n
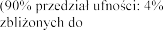
-
dawki maksymalnej.
Warfaryna
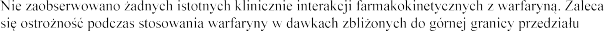
terapeutycznego.
Substraty dla CYP3A4
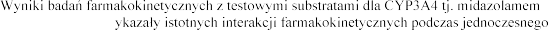
i cyzaprydem nie w stosowania z eplerenonem.
Inhibitory CYP3A4
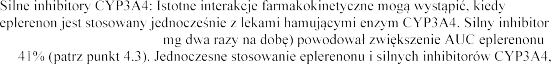
-
CYP3A4 (ketokonazol 200
o 4
takich jak ketokonazol, itrakonazol, rytonawir, nelfinawir, klarytromycyna, telitromycyna i nefazodon, jest przeciwwskazane (patrz punkt 4.3).

- bitory CYP3A4: Jednoczesne stosowanie eplerenonu i
eplerenonu w dawce ej
Induktory CYP3A4
zmniejszenie A

(ryfampicyna, karbamazepina, fenytoina, fenobarbital, ziele dziurawca) i eplerenonu nie jest zalecane (patrz punkt 4.4).
e
4.6
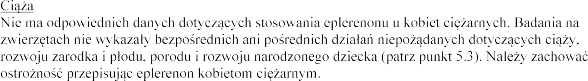
Nie wiadomo, czy eplerenon po podaniu doustnym przenika do z
mleku
produktu
po
jego stosowania dla pacjentki.


4.7
maszyny
podczas leczenia.
4.8
 Eplerenone Post-acute Myocardial Infarction Heart Failure Efficacy and Survival Study [EPHESUS] i Eplerenone in Mild Patients Hospitalization and Survival Study in Heart
Eplerenone Post-acute Myocardial Infarction Heart Failure Efficacy and Survival Study [EPHESUS] i Eplerenone in Mild Patients Hospitalization and Survival Study in Heart
Failure [EMPHASIS-HF]
wprowadzeniu eplerenonu do obrotu.
000 do
<1/100);
.

Tabela 1 badaniach kontrolowanych placebo

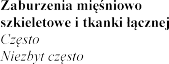
z zastosowaniem eplerenonu
|
|
| odmiedniczkowe zapalenie nerek, e |
| eozynofilia |
Zaburzenia endokrynologiczne
|
|
Zaburzenia metabolizmu i
| hiperkaliemia (patrz punkty 4.3 i 4.4), hipercholesterolemia hiponatremia, odwodnienie, hipertriglicerydemia |
Zaburzenia psychiczne
|
|
nerwowego
| omdlenie, |
Zaburzenia serca
|
tachykardia |
Zaburzenia naczyniowe
|
|
oddechowego, klatki
| kaszel |
| e, wymioty e |
|
|
- |
|
moczowych
|
|
|
|
rozrodczego i piersi
| ginekomastia |
miejscu podania |
|
|
|
Badania diagnostyczne
| enie a mocznika i kreatyniny we krwi czynnika wzrostu, enie a glukozy we krwi |
bardzo
W badaniu EMPHASIS-

partamentu Monitorowania

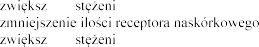
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl Dzia
4.9 Przedawkowanie
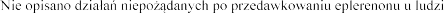
i (lub) hiperkaliemia.
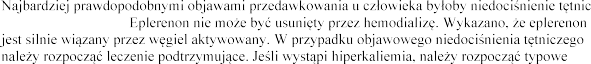
ze
leczenie.
5. 
5.1
z rekombinowanymi ludzkimi receptorami
dla
e renina-angiotensyna-
w
-naczyniowych.

eplerenonu.
-IV wg
NYHA), dodanie eplerenonu do leczenia standardowego skut od

w tych populacjach.

z
3-
14
mmol/1. Podczas badania, pacjenci otrzymywali standardowe leczenie, w tym kwas acetylosalicylowy (92%), inhibitory ACE (90%), beta-adrenolityki (83%),
we (66%) lub inhibitory reduktazy HMG CoA (60%).

-
14,4%
hospitalizacja z przyczyn sercowo- oraz u 30,0%
w
-
z przyczyn sercowo-naczyniowych. Ryzyko zgonu lub hospitalizacji z przyczyn sercowo-
-
-
hiperkaliemii wyn

Nie za
W badaniu EMPHASIS-
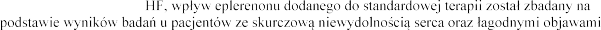
(klasa funkcyjna II wg NYHA).

serca LV
hospitalizowani z przyczyn sercowo-
cznego (ang. Brain Natriuretic Peptide -
- -BNP w osoczu
30-49 ml/min/1,73 m2

m eplerenonu lub placebo, dodanych do terapii podstawowej
z
angi -
-naczyniowych przez okres 6 mie
Cardiac Resynchronization Therapy-CRT).
, zgon z przyczyn sercowo-naczyniowych lub hospitalizacja z powodu
(RR 0,63, 95% CI, 0,54-0,74; p nonu
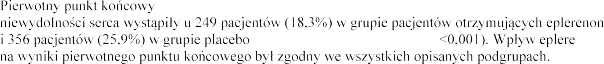
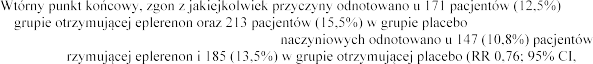
w (RR 0,76; 95% CI,
0,62-0,93; p=0,008). Zgon z przyczyn sercowo- w grupie ot
0,61-0,94; p=0,01).
W trakcie badania, hiperkali u 158
(p< statystycz
ie potasu w surowicy >5,5 mmol/l) odnotowano
ia potasu w surowicy <4,0 mmol/l

W
6 lat,
cznego zmniejszenia
w wieku od 5 do 17 lat),
w wieku
punkt 4.2).
na


5.2
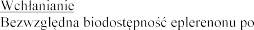
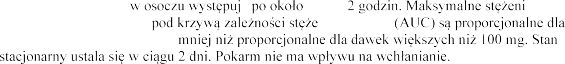
podaniu doustnym tabletki o mocy 100 mg wynosi 69%.
dawek od 10 mg do 100 mg, i | e | 1,5 do nia od czasu | e w osoczu |
Dystrybucja Eplerenon | - |
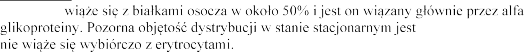
oceniana na 42-90 l. Eplerenon
Metabolizm Eplerenon jest Nie
-450.
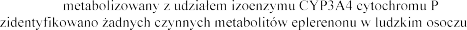
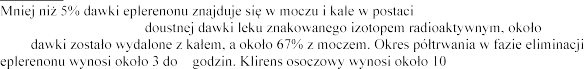
Eliminacja
Po podaniu pojedynczej 32%
niezmienionej.
6 l/h.
Specjalne grupy pacje

Farmakokinetyka eplerenonu w dawce 100
max lat). W stanie
stacjonarnym Cmax punkt 4.2).
-
ucji eplerenonu, ale nie na
w

u
stacjonarnym AUC i Cmax
reatyniny.

(klasa B w skali Child Pugh)
Cmax w
eplerenon jest przeciwwskazany w tej grupie pacj

II-
, w stanie stacjonarnym Cmax
rca

5.3
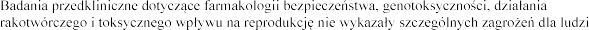
u
klinicznych. Zmiany w gruczole krokowym nie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Okres
do stosowania
PODMIOT ODPOWIEDZIALNY POSIADA
 DOPUSZCZENIE DO OBROTU
DOPUSZCZENIE DO OBROTUNUMER NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I
DATA ZATWIERDZENIA LUB
 CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Laktoza jednowodna Celuloza mikrokrystaliczna Kroskarmeloza sodowa Hypromeloza 15cP Magnezu stearynian
Sodu laurylosiarczan
Otoczka tabletki:
Hypromeloza 6 cP
Makrogol 3350
Tytanu dwutlenek (E 171) Laktoza jednowodna Triacetyna
4 lata
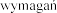
Bez specjalnych
-
Espiro 25 mg: Pozwolenie nr 20068
Espiro 50 mg: Pozwolenie nr 20069
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 08.05.2012 r. Data  12.05.2017 r.
12.05.2017 r.
28.05.2020 r.