Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
w monoterapii do leczenia raka piersi z obecnymi receptorami estrogenowymi, miejscowo zaawansowanego lub z przerzutami, u kobiet po menopauzie:
wcześniej nieleczonych terapią hormonalną lub
z nawrotem choroby podczas lub po zakończeniu leczenia uzupełniającego lekiem z grupy antyestrogenów lub, gdy nastąpiła progresja choroby podczas leczenia lekiem z grupy antyestrogenów;
w skojarzeniu z palbocyklibem w leczeniu miejscowo zaawansowanego lub rozsianego raka piersi z obecnością receptorów hormonalnych (ang. hormone receptor, HR), bez nadmiernej ekspresji receptora ludzkiego naskórkowego czynnika wzrostu 2 (ang. human epidermal growth factor receptor 2, HER2) u kobiet, które wcześniej otrzymały leczenie hormonalne (patrz punkt 5.1).
U kobiet przed menopauzą i w okresie okołomenopauzalnym leczenie skojarzone z palbocyklibem należy stosować jednocześnie z agonistą hormonu uwalniającego hormon luteinizujący
(ang. luteinizing hormone releasing hormone, LHRH).
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Należy wyjąć szklaną ampułkę z pojemnika i sprawdzić, czy nie jest uszkodzona.
Otworzyć opakowanie zewnętrzne igły z systemem zabezpieczającym (SafetyGlide).
Przed podaniem roztworów parenteralnych należy dokonać ich wizualnej oceny w celu wykrycia obecności cząstek stałych i zmiany barwy.
Trzymać strzykawkę pionowo w części prążkowanej (C). Drugą ręką chwycić nasadkę (A) i ostrożnie przechylać do przodu i ostrożnie przekręcić plastikową nasadkę w kierunku przeciwnym do ruchu wskazówek zegara (patrz Rysunek 1).
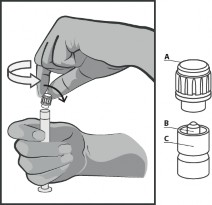
Rysunek 1
Usunąć nasadkę (A) w pozycji pionowej ku górze. W celu zachowania sterylności nie dotykać końcówki strzykawki (B) (patrz Rysunek 2).
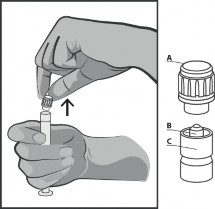
Rysunek 2
Dołączyć igłę z systemem zabezpieczającym do końcówki Luer-Lock i dokręcić w celu trwałego umocowania (patrz Rysunek 3).
Sprawdzić czy igła jest połączona z końcówką Luer przed przejściem do pozycji pionowej.
Przy dokręcaniu igły należy postępować tak, aby nie uszkodzić jej ostrego końca.
Igłę z nasadką należy zbliżyć do miejsca podania.
Zdjąć nasadkę z igły.
Usunąć nadmiar powietrza ze strzykawki.
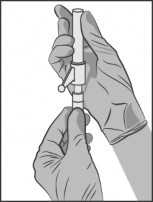
Rysunek 3
Podawać domięśniowo, powoli (1-2 minuty/wstrzyknięcie), w mięsień pośladkowy (miejsce na pośladku). Dla wygody osoby podającej, ścięcie igły znajduje się na tej samej powierzchni igły co dźwignia systemu zabezpieczającego igłę (patrz Rysunek 4).
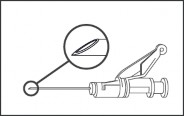
Rysunek 4
Natychmiast po wstrzyknięciu należy uruchomić system zabezpieczający igłę przez popchnięcie do przodu jego dźwigni (patrz Rysunek 5).
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Fulvestrant Fresenius Kabi, 250 mg/5 ml, roztwór do wstrzykiwań w ampułko-strzykawce
Jedna ampułko-strzykawka zawiera 250 mg fulwestrantu w 5 ml roztworu. Substancje pomocnicze o znanym działaniu (w 5 ml)
Etanol (96%), 500 mg Alkohol benzylowy, 500 mg Benzylu benzoesan, 750 mg
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań w ampułko-strzykawce.
Przezroczysty, bezbarwny do żółtego, lepki roztwór, bez widocznych cząstek stałych.
Fulvestrant Fresenius Kabi jest wskazany:
Dawkowanie
Dorosłe pacjentki (także starsze pacjentki)
Zalecana dawka produktu leczniczego to 500 mg, podawana w odstępach jednomiesięcznych z dodatkową dawką 500 mg po upływie 2 tygodni od podania pierwszej dawki.
Gdy fulwestrant jest stosowany w skojarzeniu z palbocyklibem, należy zapoznać się z Charakterystyką Produktu Leczniczego palbocyklibu.
Przed rozpoczęciem leczenia skojarzonego fulwestrantem z palbocyklibem i przez cały czas jego trwania, pacjentki w wieku przed- i okołomenopauzalnym powinny otrzymywać leczenie agonistami LHRH zgodnie z lokalnie przyjętą praktyką kliniczną.
Szczególne grupy pacjentów
Zaburzenia czynności nerek
Nie ma konieczności zmiany dawki u pacjentek z łagodnymi do umiarkowanych zaburzeniami czynności nerek (klirens kreatyniny ≥30 ml/min). Nie badano skuteczności i bezpieczeństwa stosowania fulwestrantu u pacjentek z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny
<30 ml/min), dlatego zaleca się ostrożność podczas stosowania produktu leczniczego w tej grupie pacjentek (patrz punkt 4.4).
Zaburzenia czynności wątroby
Nie ma konieczności zmiany dawki produktu leczniczego u pacjentek z łagodnymi i umiarkowanymi zaburzeniami czynności wątroby. Jednak w tej grupy pacjentek fulwestrant należy stosować ostrożnie ze względu na możliwość zwiększenia ekspozycji na fulwestrant. Brak danych dotyczących stosowania u pacjentek z ciężkimi zaburzeniami czynności wątroby (patrz punkty 4.3, 4.4 i 5.2).
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności fulwestrantu u dzieci i młodzieży w wieku do 18 lat. Aktualne dane przedstawiono w punkcie 5.1 i 5.2, ale niemożliwe jest ustalenie dawkowania.
Sposób podawania
Fulvestrant Fresenius Kabi należy podawać powoli (czas jednego wstrzyknięcia 1-2 minuty), domięśniowo w dwóch kolejnych wstrzyknięciach po 5 ml, każde w inny pośladek (mięsień pośladkowy).
Należy zachować ostrożność podczas podawania produktu leczniczego Fulvestrant Fresenius Kabi w górno-boczną okolicę pośladka ze względu na bliskość nerwu kulszowego.
Instrukcja dotycząca podawania, patrz punkt 6.6.
Nadwrażliwość na substancję czynną lub którąkolwiek substancję pomocniczą, wymienioną w punkcie 6.1.
Ciąża i okres karmienia piersią (patrz punkt 4.6).
Ciężkie zaburzenia czynności wątroby (patrz punkty 4.4 i 5.2).
Fulwestrant należy stosować ostrożnie u pacjentek z łagodnymi i umiarkowanymi zaburzeniami czynności wątroby (patrz punkt 4.2, 4.3 i 5.2).
Fulwestrant należy stosować ostrożnie u pacjentek z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny mniejszy niż 30 ml/min).
Ze względu na domięśniową drogę podania, fulwestrant należy stosować ostrożnie u pacjentek ze skazą krwotoczną, małopłytkowością lub stosujących leki przeciwzakrzepowe.
U pacjentek z zaawansowanym rakiem piersi często występują zaburzenia zatorowo-zakrzepowe. Zaburzenia te obserwowano także u pacjentek w badaniach klinicznych z zastosowaniem fulwestrantu (patrz punkt 4.8). Należy wziąć to pod uwagę stosując fulwestrant u pacjentek z grupy ryzyka.
Zgłaszano następujące reakcje w miejscu wstrzyknięcia fulwestrantu: rwa kulszowa, nerwoból, ból neuropatyczny i neuropatia obwodowa. Należy zachować ostrożność podczas podawania fulwestrantu w górno-boczną okolicę pośladka ze względu na bliskość nerwu kulszowego (patrz punkty 4.2 i 4.8).
Brak jest danych dotyczących odległych skutków działania fulwestrantu na kości. W związku z mechanizmem działania fulwestrantu istnieje potencjalne ryzyko wystąpienia osteoporozy.
Nie badano skuteczności i bezpieczeństwa stosowania fulwestrantu (podawanego w monoterapii lub w skojarzeniu z palbocyklibem) u pacjentek z masywnymi przerzutami do narządów miąższowych.
Jeżeli fulwestrant jest stosowany w skojarzeniu z palbocyklibem, należy zapoznać się także z Charakterystyką Produktu Leczniczego palbocyklibu.
Interakcje z testami przeciwciał estradiolu
Ze względu na podobieństwo struktury fulwestrantu i estradiolu, fulwestrant może wpływać na wyniki testów wykrywających poziom estradiolu a opartych na przeciwciałach oraz może powodować fałszywie dodatnie wyniki wskazujące na wysoki poziomu estradiolu.
Etanol
Ten produkt leczniczy zawiera 500 mg alkoholu (etanolu) w każdej ampułko-strzykawce, co jest równoważne 100 mg/ml (10% w/v). Ilość alkoholu w każdym wstrzyknięciu tego produktu leczniczego jest równoważna 13 ml piwa lub 5 ml wina.
Dawka 500 mg tego produktu leczniczego (2 ampułko-strzykawki) podana dorosłej kobiecie o masie ciała 70 kg spowoduje narażenie na etanol wynoszące 14,3 mg/kg mc., co może spowodować zwiększenie stężenia alkoholu we krwi (ang. blood alcohol concentration, BAC) o około
2,4 mg/100 ml (patrz załącznik 1 do raportu EMA/CHMP/43486/2018). Dla porównania, u osoby dorosłej pijącej kieliszek wina lub 500 ml piwa, stężenie alkoholu we krwi wyniesie prawdopodobnie około 50 mg/100 ml.
Jednoczesne podawanie z lekami zawierającymi, np. glikol propylenowy lub etanol może prowadzić do kumulacji etanolu i wywoływać działania niepożądane.
Alkohol benzylowy
Ten produkt leczniczy zawiera 500 mg alkoholu benzylowego w każdej ampułko-strzykawce. Alkohol benzylowy może powodować reakcje alergiczne.
Dzieci i młodzież
Fulwestrant nie jest zalecany do stosowania u dzieci i młodzieży, ponieważ nie zostało ustalone bezpieczeństwo stosowania i skuteczność w tej grupie pacjentów (patrz punkt 5.1).
Wyniki badania klinicznego dotyczącego interakcji z midazolamem (substratem CYP 3A4) wykazują, że fulwestrant nie wpływa hamująco na CYP 3A4. W przeprowadzonych badaniach klinicznych dotyczących interakcji z ryfampicyną (działa pobudzająco na CYP 3A4) i ketokonazolem (działa hamująco na CYP 3A4), nie stwierdzono istotnej klinicznie zmiany klirensu fulwestrantu. W związku z powyższym nie ma konieczności zmiany dawki fulwestrantu, jeśli jest on stosowany jednocześnie
z innymi lekami o działaniu hamującym lub pobudzającym aktywność CYP 3A4.
Kobiety w wieku rozrodczym
Pacjentki w wieku rozrodczym powinny stosować skuteczną antykoncepcję w trakcie leczenia produktem leczniczym Fulvestrant Fresenius Kabi i przez 2 lata po przyjęciu ostatniej dawki.
Ciąża
Fulwestrant jest przeciwwskazany do stosowania w ciąży (patrz punkt 4.3). W badaniach na szczurach i królikach wykazano, że fulwestrant po podaniu pojedynczej dawki domięśniowo przenika przez łożysko. Badania na zwierzętach wykazały toksyczny wpływ na reprodukcję, w tym zwiększoną liczbę nieprawidłowości i zgonów płodów (patrz punkt 5.3). Jeśli podczas stosowania fulwestrantu zostanie stwierdzona ciąża, pacjentkę należy niezwłocznie poinformować o potencjalnym ryzyku uszkodzenia płodu i utraty ciąży.
Karmienie piersią
W przypadku konieczności rozpoczęcia leczenia fulwestrantem należy przerwać karmienie piersią. Fulwestrant przenika do mleka karmiących samic szczura. Nie wiadomo, czy fulwestrant przenika do mleka ludzkiego. W związku z możliwością wystąpienia ciężkich działań niepożądanych
u karmionego piersią dziecka, którego matka jest leczona fulwestrantem, stosowanie produktu leczniczego w okresie karmienia piersią jest przeciwwskazane (patrz punkt 4.3).
Płodność
Nie badano wpływu stosowania fulwestrantu na płodność u ludzi.
Fulwestrant nie ma wpływa lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów
i obsługiwania maszyn. Jednak w trakcie stosowania fulwestrantu bardzo często występuje astenia. Pacjenci, u których występuje to działanie niepożądane, powinni zachować szczególną ostrożność podczas prowadzenia pojazdów i obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Monoterapia
W tym punkcie przedstawiono informacje dotyczące wszystkich działań niepożądanych, uzyskane podczas badań klinicznych, stosowania klinicznego po dopuszczeniu fulwestrantu do obrotu lub pochodzące ze zgłoszeń spontanicznych. W zbiorczej grupie danych dotyczących stosowania fulwestrantu w monoterapii, do najczęściej opisywanych działań niepożądanych należały odczyny w miejscu podania, astenia, nudności i zwiększenie aktywności enzymów wątrobowych (AlAT, AspAT, fosfataza alkaliczna).
Kategorie częstości występowania działań niepożądanych podane w Tabeli 1 zostały zdefiniowane w oparciu o zbiorcze analizy bezpieczeństwa stosowania w grupie terapeutycznej przyjmującej fulwestrant w dawce 500 mg w badaniach porównujących fulwestrant w dawce 500 mg z fulwestrantem w dawce 250 mg [CONFIRM (badanie D6997C00002), FINDER 1 (badanie
D6997C00004), FINDER 2 (badanie D6997C00006), NEWEST (badanie D6997C00003)] lub tylko z
badania FALCON (badanie D699BC00001), w którym porównywano fulwestrant w dawce 500 mg z anastrozolem w dawce 1 mg. W przypadku różnic w częstości występowania między zbiorczą analizą bezpieczeństwa a badaniem FALCON, przedstawiono największą częstość występowania. Częstości wymienione w poniższej tabeli są podane w oparciu o wszystkie zgłoszone zdarzenia niepożądane niezależnie od oceny związku przyczynowo-skutkowego przez badacza. Mediana czasu trwania leczenia fulwestrantem w dawce 500 mg dla zbiorczej grupy danych (w tym w badaniach wymienionych wyżej i w badaniu FALCON) wyniosła 6,5 miesiąca.
Tabelaryczne zestawienie działań niepożądanych
Działania niepożądane zostały podane zgodnie z częstością ich występowania w poszczególnych układach. Częstość występowania działań niepożądanych: bardzo często (≥1/10), często (≥1/100 do
<1/10), niezbyt często (≥1/1000 do <1/100). W każdej grupie o określonej częstości występowania działania niepożądane zostały wymienione według zmniejszającego się nasilenia.
Tabela 1 Działania niepożądane zgłaszane u pacjentek leczonych fulwestrantem w monoterapii
Działania niepożądane zgodnie z częstością ich występowania w poszczególnych układach | ||
Zakażenia i zarażenia pasożytnicze | Często | Zakażenia dróg moczowych |
Zaburzenia krwi i układu chłonnego | Często | Zmniejszenie liczby płytek krwie |
Zaburzenia układu immunologicznego | Bardzo często | Reakcje nadwrażliwoście |
Niezbyt często | Reakcje anafilaktyczne | |
Zaburzenia metabolizmu i odżywiania | Często | Anoreksjaa |
Zaburzenia układu nerwowego | Często | Ból głowy |
Zaburzenia naczyniowe | Bardzo często | Uderzenia gorącae |
Często | Żylna choroba zakrzepowo-zatorowaa | |
Zaburzenia żołądka i jelit | Bardzo często | Nudności |
Często | Wymioty, biegunka | |
Zaburzenia wątroby i dróg żółciowych | Bardzo często | Zwiększenie aktywności enzymów wątrobowych (AlAT, AspAT, fosfataza zasadowa)a |
Często | Zwiększenie stężenia bilirubinya | |
Niezbyt często | Niewydolność wątrobyc, f,, zapalenie wątrobyf, zwiększenie aktywności gamma-glutamylotranspeptydazy (GGTP)f | |
Zaburzenia skóry i tkanki podskórnej | Bardzo często | Wysypkae |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | Bardzo często | Bóle mięśniowo-szkieletowe i stawówd |
Często | Bóle plecówa | |
Zaburzenia układu rozrodczego i piersi | Często | Krwawienia z pochwye |
Niezbyt często | Kandydoza pochwyf, obfite białe upławyf | |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | Asteniaa, reakcje w miejscu podaniab |
Często | Neuropatia obwodowae, rwa kulszowae | |
Niezbyt często | Krwotok z miejsca podaniaf, krwiak w miejscu podaniaf, nerwobólc, f | |
a Dotyczy działań niepożądanych, dla których dokładny zakres udziału fulwestrantu nie może być określony z powodu istnienia choroby podstawowej.
b Termin reakcje w miejscu podania nie obejmuje terminów krwotok z miejsca podania, krwiak w miejscu podania, rwa kulszowa, nerwoból i neuropatia obwodowa.
c Zdarzenia nie obserwowano podczas dużych badań klinicznych (CONFIRM, FINDER 1, FINDER 2, NEWEST). Częstość występowania zdarzenia obliczono przyjmując górną granicę 95% przedziału ufności dla estymacji w punkcie. Uzyskano wartość 3/560 (gdzie 560 to liczba pacjentów w dużych badaniach klinicznych), co odpowiada przedziałowi „niezbyt często” dla częstości występowania zdarzeń niepożądanych.
d Obejmuje: ból stawów i rzadziej bóle mięśniowo-szkieletowe, ból mięśni oraz ból kończyny.
e Kategoria częstości różni się między danymi pochodzącymi ze zbiorczej analizy bezpieczeństwa a badaniem FALCON.
f Tego działania niepożądanego nie obserwowano w badaniu FALCON.
Opis wybranych działań niepożądanych
Podane niżej opisy opierają się na analizie bezpieczeństwa obejmującej 228 pacjentek, które otrzymały przynajmniej jedną (1) dawkę fulwestrantu i 232 pacjentek, które otrzymały przynajmniej jedną (1) dawkę anastrozolu w badaniu III fazy FALCON.
Bóle mięśniowo-szkieletowe i stawów
W badaniu FALCON liczba pacjentek zgłaszających działanie niepożądane w postaci bólów mięśniowo-szkieletowych i stawów wyniosła 65 (31,2%) i 48 (24,1%) odpowiednio w grupie fulwestrantu i anastrozolu. Czterdzieści procent (40%) pacjentek (26/65) spośród 65 z grupy otrzymującej fulwestrant zgłaszało bóle mięśniowo-szkieletowe i stawów w pierwszym miesiącu leczenia, a 66,2% (43/65) pacjentek zgłaszało te bóle w pierwszych 3 miesiącach leczenia. Żadna
z pacjentek nie zgłosiła zdarzeń o stopniu nasilenia ≥3 wg CTCAE lub wymagających zmniejszenia dawki, przerwania podawania leku bądź zakończenia leczenia z powodu tych działań niepożądanych.
Leczenie skojarzone z palbocyklibem
Ogólny profil bezpieczeństwa fulwestrantu stosowanego w skojarzeniu z palbocyklibem opiera się na danych pochodzących od 517 pacjentek z miejscowo zaawansowanym lub rozsianym rakiem piersi
z obecnością receptorów hormonalnych, bez nadmiernej ekspresji receptora ludzkiego naskórkowego czynnika wzrostu 2, uczestniczących w randomizowanym badaniu PALOMA3 (patrz punkt 5.1).
Najczęstszymi (≥20%) działaniami niepożądanymi dowolnego stopnia nasilenia, zgłaszanymi
u pacjentek otrzymujących fulwestrant w skojarzeniu z palbocyklibem były neutropenia, leukopenia, zakażenia, uczucie zmęczenia, nudności, niedokrwistość, zapalenie jamy ustnej, biegunka, małopłytkowość i wymioty. Najczęstszymi (≥2%) działaniami niepożądanymi w stopniu nasilenia
≥3 były neutropenia, leukopenia, zakażenia, niedokrwistość, zwiększenie aktywności AspAT, małopłytkowość i uczucie zmęczenia.
W Tabeli 2. przedstawiono działania niepożądane występujące w badaniu PALOMA3.
Mediana czasu trwania ekspozycji na fulwestrant wyniosła 11,2 miesiąca w grupie otrzymującej fulwestrant w skojarzeniu z palbocyklibem oraz 4,8 miesiąca w grupie otrzymującej fulwestrant plus placebo. Mediana czasu trwania ekspozycji na palbocyklib w grupie otrzymującej fulwestrant
w skojarzeniu z palbocyklibem wyniosła 10,8 miesiąca.
Tabela 2 Działania niepożądane na podstawie danych pochodzących z badania PALOMA3 (N=517)
Klasyfikacja układów i narządów Częstość występowania Preferowana terminologiaa | Fulwestrant + palbocyklib (N=345) | Fulwestrant + placebo (N=172) | ||
Wszystkie stopnie nasilenia n (%) | Stopień ≥3 n (%) | Wszystkie stopnie nasilenia n (%) | Stopień ≥3 n (%) | |
Zakażenia i zarażenia pasożytnicze | ||||
Bardzo często | ||||
Zakażeniab | 188 (54,5) | 19 (5,5) | 60 (34,9) | 6 (3,5) |
Zaburzenia krwi i układu chłonnego | ||||
Bardzo często | ||||
Neutropeniac | 290 (84,1) | 240 (69,6) | 6 (3,5) | 0 |
Leukopeniad | 207 (60,0) | 132 (38,3) | 9 (5,2) | 1 (0,6) |
Niedokrwistośće | 109 (31,6) | 15 (4,3) | 24 (14,0) | 4 (2,3) |
Małopłytkowośćf | 88 (25,5) | 10 (2,9) | 0 | 0 |
Niezbyt często | ||||
Gorączka neutropeniczna | 3 (0,9) | 3 (0,9) | 0 | 0 |
Zaburzenia metabolizmu i odżywiania | ||||
Bardzo często | ||||
Zmniejszenie apetytu | 60 (17,4) | 4 (1,2) | 18 (10,5) | 1 (0,6) |
Zaburzenia układu nerwowego | ||||
Często | ||||
Zaburzenia smaku | 27 (7,8) | 0 | 6 (3,5) | 0 |
Zaburzenia oka | ||||
Często | ||||
Nasilone łzawienie | 25 (7,2) | 0 | 2 (1,2) | 0 |
Nieostre widzenie | 24 (7,0) | 0 | 3 (1,7) | 0 |
Suchość oka | 15 (4,3) | 0 | 3 (1,7) | 0 |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | ||||
Często | ||||
Krwawienie z nosa | 25 (7,2) | 0 | 4 (2,3) | 0 |
Zaburzenia żołądka i jelit | ||||
Bardzo często | ||||
Nudności | 124 (35,9) | 2 (0,6) | 53 (30,8) | 1 (0,6) |
Zapalenie jamy ustnejg | 104 (30,1) | 3 (0,9) | 24 (14,0) | 0 |
Biegunka | 94 (27,2) | 0 | 35 (20,3) | 2 (1,2) |
Wymioty | 75 (21,7) | 2 (0,6) | 28 (16,3) | 1 (0,6) |
Zaburzenia skóry i tkanki podskórnej | ||||
Bardzo często | ||||
Łysienie | 67 (19,4) | NA | 11 (6,4) | NA |
Wysypkah | 63 (18,3) | 3 (0,9) | 10 (5,8) | 0 |
Często | ||||
Suchość skóry | 28 (8,1) | 0 | 3 (1,7) | 0 |
Zaburzenia ogólne i stany w miejscu podania | ||||
Bardzo często | ||||
Uczucie zmęczenia | 152 (44,1) | 9 (2,6) | 54 (31,4) | 2 (1,2) |
Gorączka | 47 (13,6) | 1 (0,3) | 10 (5,8) | 0 |
Często | ||||
Osłabienie | 27 (7,8) | 1 (0,3) | 13 (7,6) | 2 (1,2) |
Badania diagnostyczne | ||||
Bardzo często | ||||
Zwiększenie aktywności AspAT | 40 (11,6) | 11 (3,2) | 13 (7,6) | 4 (2,3) |
Często | ||||
Zwiększenie aktywności AlAT | 30 (8,7) | 7 (2,0) | 10 (5,8) | 1 (0,6) |
AlAT=aminotransferaza alaninowa; AspAT=aminotransferaza asparaginianowa; N/n=liczba pacjentów; NA=nie dotyczy
a Preferowana terminologia (PT) podana zgodnie z MedDRA 17.1.
b Zakażenia obejmują wszystkie PT należące do zakażeń i zarażeń pasożytniczych w klasyfikacji układów i narządów.
c Neutropenia obejmuje następujące PT: neutropenię, zmniejszoną liczbę neutrofilów.
d Leukopenia obejmuje następujące PT: leukopenię, zmniejszoną liczbę białych krwinek.
e Niedokrwistość obejmuje następujące PT: niedokrwistość, zmniejszenie stężenia hemoglobiny, zmniejszenie wartości hematokrytu.
f Małopłytkowość obejmuje następujące PT: małopłytkowość, zmniejszoną liczbę płytek krwi.
g Zapalenie jamy ustnej obejmuje następujące PT: aftowe zapalenie jamy ustnej, zapalenie czerwieni warg, zapalenie języka, ból języka, owrzodzenie jamy ustnej, zapalenie błony śluzowej, ból jamy ustnej, uczucie dyskomfortu w jamie ustnej i gardle, ból jamy ustnej i gardła, zapalenie jamy ustnej. h Wysypka obejmuje następujące PT: wysypkę, wysypkę grudkowo-plamkową, wysypkę ze świądem, wysypkę z rumieniem, wysypkę grudkową, zapalenie skóry, trądzikopodobne zapalenie skóry, toksyczne wykwity skórne.
Opis wybranych działań niepożądanych
Neutropenia
U pacjentek otrzymujących fulwestrant w skojarzeniu z palbocyklibem w badaniu PALOMA3 neutropenię dowolnego stopnia zgłaszano u 290 (84,1%) pacjentek, przy czym neutropenię
w 3. stopniu nasilenia zgłoszono u 200 (58,0%) pacjentek, a neutropenię w 4. stopniu nasilenia zgłoszono u 40 (11,6%) pacjentek. W grupie otrzymującej fulwestrant w skojarzeniu z placebo (n=172) neutropenię dowolnego stopnia zgłaszano u 6 (3,5%) pacjentek. Nie zgłaszano występowania neutropenii w 3. i 4. stopniu nasilenia w grupie otrzymującej fulwestrant w skojarzeniu z placebo.
U pacjentek otrzymujących fulwestrant w skojarzeniu z palbocyklibem mediana czasu do wystąpienia pierwszego epizodu neutropenii dowolnego stopnia nasilenia wyniosła 15 dni (zakres: 13-512),
a mediana czasu trwania neutropenii stopnia ≥3 wyniosła 16 dni. Gorączkę neutropeniczną zgłaszano u 3 (0,9%) pacjentek otrzymujących fulwestrant w skojarzeniu z palbocyklibem.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C 02-222 Warszawa
tel.: +48 22 49 21 301
faks: +48 22 49 21 309
strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Zgłoszono pojedyncze przypadki przedawkowania fulwestrantu u ludzi. W przypadku przedawkowania należy zastosować objawowe leczenie wspomagające. Z badań przeprowadzonych na zwierzętach wynika, że w przypadku stosowania fulwestrantu w dawkach większych niż zalecane należy oczekiwać objawów związanych z bezpośrednim lub pośrednim działaniem antyestrogenowym (patrz punkt 5.3).
Grupa farmakoterapeutyczna: leki stosowane w terapii hormonalnej, antyestrogeny, kod ATC: L02BA 03
Mechanizm działania i aktywność farmakodynamiczna
Fulwestrant jest kompetycyjnym antagonistą receptora estrogenowego, wykazując porównywalne z estradiolem powinowactwo. Fulwestrant blokuje troficzne działanie estrogenów nie wykazując
nawet częściowego (estrogenopodobnego) działania agonistycznego. Mechanizm działania polega na zmniejszeniu ilości (down-regulation) białka receptorowego receptora estrogenowego. W badaniach klinicznych, u kobiet po menopauzie, z pierwotnym rakiem piersi, stwierdzono, że fulwestrant
w porównaniu z placebo znacząco zmniejszał ilość (down-regulation) białka receptora estrogenowego w guzach zawierających receptory estrogenowe (ER). Stwierdzono także, że w znaczącym stopniu zmniejszyła się ekspresja receptora progesteronowego, co potwierdza brak wewnętrznej aktywności estrogenowej. W przypadku leczenia neoadjuwantowego guzów piersi u kobiet po menopauzie wykazano także, że fulwestrant w dawce 500 mg w większym stopniu ogranicza ekspresję receptora estrogenowego i markera proliferacji Ki67 niż fulwestrant w dawce 250 mg.
Skuteczność kliniczna i bezpieczeństwo w zaawansowanym raku piersi
Monoterapia
Przeprowadzono badanie kliniczne trzeciej fazy u 736 kobiet po menopauzie z zaawansowanym rakiem piersi, u których doszło do nawrotu w trakcie lub po zakończeniu hormonalnego leczenia uzupełniającego, albo do progresji po leczeniu hormonalnym nowotworu zaawansowanego. Do badania włączono 423 pacjentki, u których doszło do nawrotu albo do progresji w trakcie leczenia antyestrogenami (podgrupa antyestrogenów) i 313 pacjentek, u których doszło do nawrotu albo do progresji w trakcie leczenia inhibitorami aromatazy (podgrupa inhibitorów aromatazy). Celem tego badania było porównanie skuteczności i bezpieczeństwa fulwestrantu w dawce 500 mg (n=362)
i w dawce 250 mg (n=374). Pierwszorzędowym punktem końcowym był czas wolny od progresji choroby (PFS), najważniejsze drugorzędowe punkty końcowe, które miały na celu ocenę skuteczności leczenia, objęły odsetek odpowiedzi obiektywnych (ORR), odsetek chorych, u których stwierdzono
korzyść kliniczną (CBR) i przeżycie całkowite (OS). Wyniki badania CONFIRM, dotyczące skuteczności leczenia podsumowano w tabeli 3.
Tabela 3 Podsumowanie wyników skuteczności leczenia w badaniu CONFIRM: pierwszorzędowy punkt końcowy (PFS) i najważniejsze drugorzędowe punkty końcowe.
Zmienna | Sposób oceny; porównanie leczenia | Fulwestrant 500 mg (N=362) | Fulwestrant 250 mg (N=374) | Porównanie między grupami (Fulwestrant 500 mg/Fulwestrant 250 mg) | ||
Współczynnik ryzyka | 95% CI | Wartość p | ||||
PFS | Mediana wyznaczona na podstawie wykresu K-M Współczynnik ryzyka | |||||
Wszystkie pacjentki | 6,5 | 5,5 | 0,80 | 0,68, 0,94 | 0,006 | |
Podgrupa AE (n=423) | 8,6 | 5,8 | 0,76 | 0,62, 0,94 | 0,013 | |
Podgrupa AI (n=313)a | 5,4 | 4,1 | 0,85 | 0,67, 1,08 | 0,195 | |
OSb | Mediana wyznaczona na podstawie wykresu K-M Współczynnik ryzyka | |||||
Wszystkie pacjentki | 26,4 | 22,3 | 0,81 | 0,69, 0,96 | 0,016c | |
Podgrupa AE (n=423) | 30,6 | 23,9 | 0,79 | 0,63, 0,99 | 0,038c | |
Podgrupa AI (n=313)a | 24,1 | 20,8 | 0,86 | 0,67, 1,11 | 0,241c | |
Zmienna | Sposób oceny; porównanie leczenia | Fulwestrant 500 mg (N=362) | Fulwestrant 250 mg (N=374) | Porównanie między grupami (Fulwestrant 500 mg/Fulwestrant 250 mg) | ||
Bezwzględna różnica w % | 95% CI | |||||
ORRd | % pacjentek z korzyścią kliniczną Bezwzględna różnica odsetka w % | |||||
Wszystkie pacjentki | 13,8 | 14,6 | -0,8 | -5,8, 6,3 | ||
Podgrupa AE (n=296) | 18,1 | 19,1 | -1,0 | -8,2, 9,3 | ||
Podgrupa AI (n=205)a | 7,3 | 8,3 | -1,0 | -5,5, 9,8 | ||
CBRe | % pacjentek z korzyścią kliniczną Bezwzględna różnica odsetka w % | |||||
Wszystkie pacjentki | 45,6 | 39,6 | 6,0 | -1,1, 13,3 | ||
Podgrupa AE (n=423) | 52,4 | 45,1 | 7,3 | -2,2, 16,6 | |
Podgrupa AI (n=313)a | 36,2 | 32,3 | 3,9 | -6,1, 15,2 |
a Fulwestrant jest wskazany u pacjentek, u których nastąpił nawrót lub progresja choroby podczas leczenia lekami z grupy antyestrogenów. Wyniki w podgrupie inhibitorów aromatazy nie są rozstrzygające.
b OS (przeżycie całkowite) dla końcowej analizy przeżycia przy 75% dojrzałości wyników.
c Wartość p bez korekty poziomu istotności dla testów wielokrotnych (dwa testy: przy 50% i 75% dojrzałości wyników).
d ORR oceniano u pacjentek, które na wstępie zakwalifikowano do grupy podlegającej ocenie odpowiedzi na leczenie (tzn. do grupy pacjentek, u których na początku badania możliwa była ocena wielkości zmian nowotworowych: 240 pacjentek w grupie leczonej fulwestrantem w dawce 500 mg i 261 pacjentek w grupie leczonej fulwestrantem w dawce 250 mg).
e Pacjentki z odpowiedzią obiektywną całkowitą, częściową lub korzyścią kliniczną ≥24 tygodni. PFS: czas wolny od progresji choroby; ORR: odsetek odpowiedzi obiektywnych; OR: odpowiedź obiektywna; CRB: odsetek korzyści klinicznych; CB: korzyść kliniczna; OS: przeżycie całkowite; K-M: Kaplan-Meier; CI: przedział ufności, IA; inhibitory aromatazy; AE: antyestrogeny.
Przeprowadzono randomizowane, podwójnie zaślepione, podwójnie pozorowane, wieloośrodkowe badanie trzeciej fazy porównujące fulwestrant 500 mg z anastrozolem 1 mg u kobiet po menopauzie z ER-dodatnim i (lub) PgR-dodatnim miejscowo zaawansowanym lub rozsianym rakiem piersi, które wcześniej nie otrzymywały żadnej terapii hormonalnej. Łącznie 462 pacjentki były sekwencyjnie
losowo przydzielane w stosunku 1:1 do grupy otrzymującej fulwestrant w dawce 500 mg lub do grupy otrzymującej anastrozol w dawce 1 mg.
Randomizacja była stratyfikowana według stopnia zaawansowania choroby (miejscowo zaawansowana lub rozsiana), wcześniejszej chemioterapii z powodu choroby zaawansowanej i obecności zmian, których wielkość była możliwa do oceny.
Pierwszorzędowym punktem końcowym oceny skuteczności w tym badaniu było przeżycie wolne od progresji choroby (PFS) oceniane przez badacza według kryteriów RECIST 1.1 (ang. Response Evaluation Criteria in Solid Tumours; kryteria oceny odpowiedzi w guzach litych). Najważniejsze drugorzędowe punkty końcowe oceny skuteczności obejmowały przeżycie całkowite (OS) i odsetek odpowiedzi obiektywnych (ORR).
Mediana wieku pacjentek włączonych do tego badania wyniosła 63 lata (zakres 36-90). U większości pacjentek (87,0%) przed rozpoczęciem badania występowały przerzuty. U pięćdziesięciu pięciu procent (55,0%) pacjentek przed rozpoczęciem badania występowały przerzuty do narządów miąższowych. Łącznie 17,1% pacjentek otrzymało wcześniej chemioterapię z powodu choroby zaawansowanej; u 84,2% pacjentek możliwa była ocena wielkości zmian nowotworowych.
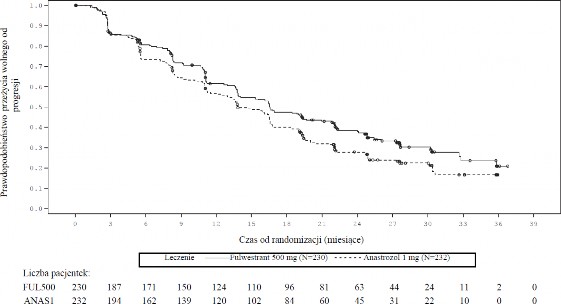
W większości predefiniowanych podgrup pacjentek otrzymane wyniki były spójne. W podgrupie pacjentek z chorobą ograniczoną do przerzutów innych niż przerzuty do narządów miąższowych (n=208), HR wyniósł 0,592 (95% CI: 0,419; 0,837) w grupie otrzymującej fulwestrant w porównaniu z grupą leczoną anastrozolem. W podgrupie pacjentek z przerzutami do narządów miąższowych (n=254) HR wyniósł 0,993 (95% CI: 0,740; 1,331) w grupie otrzymującej fulwestrant w porównaniu z grupą leczoną anastrozolem. Wyniki dotyczące skuteczności w badaniu FALCON zostały przedstawione w Tabeli 4. i na Rycinie 1.
Tabela 4. Podsumowanie wyników dotyczących pierwszorzędowego punktu końcowego oceny skuteczności (PFS) i najważniejszych drugorzędowych punktów końcowych oceny skuteczności (ocena badacza, populacja zgodna z zaplanowanym leczeniem) – badanie FALCON
Fulwestrant 500 mg (N=230) | Anastrozol 1 mg (N=232) | |
Przeżycie wolne od progresji choroby | ||
Liczba zdarzeń PFS (%) | 143 (62,2%) | 166 (71,6%) |
Współczynnik ryzyka (95% CI) i wartość p dla PFS | HR 0,797 (0,637 – 0,999) p = 0,0486 | |
Mediana PFS [miesiące (95% CI)] | 16,6 (13,8, 21,0) | 13,8 (12,0, 16,6) |
Liczba zdarzeń OS* | 67 (29,1%) | 75 (32,3%) |
Współczynnik ryzyka (95% CI) i wartość p dla OS | HR 0,875 (0,629 – 1,217) p = 0,4277 | |
ORR** | 89 (46,1%) | 88 (44,9%) |
Iloraz szans (95% CI) i wartość p dla ORR | OR 1,074 (0,716 – 1,614) p = 0,7290 | |
Mediana DoR (miesiące) | 20,0 | 13,2 |
CBR | 180 (78,3%) | 172 (74,1%) |
Iloraz szans (95% CI) i wartość p dla CBR | OR 1,253 (0,815 – 1,932) p = 0,3045 | |
*(31% dojrzałość danych) - nieostateczna analiza OS
**u pacjentek ze zmianami mierzalnymi
Rycina 1. Wykres Kaplana-Meiera dla przeżycia wolnego od progresji choroby (ocena badacza, populacja zgodna z zaplanowanym leczeniem) ─ badanie FALCON
Przeprowadzono dwa badania kliniczne III fazy, w których udział wzięło 851 kobiet po menopauzie z zaawansowanym rakiem piersi, u których nastąpił nawrót choroby w trakcie lub po zakończeniu hormonalnego leczenia uzupełniającego, lub doszło do progresji choroby podczas leczenia hormonalnego zaawansowanego raka piersi. U siedemdziesięciu siedmiu procent pacjentek (77%)
biorących udział w badaniach wykazano obecność receptora estrogenowego w komórkach raka piersi. W badaniach tych porównywano bezpieczeństwo stosowania i skuteczność fulwestrantu, podawanego w dawce 250 mg raz na miesiąc i anastrozolu, inhibitora aromatazy, podawanego raz na dobę w dawce 1 mg. Stwierdzono, że fulwestrant podawany w dawce 250 mg raz na miesiąc jest co najmniej tak skuteczny jak anastrozol, pod względem czasu wolnego od progresji choroby, obiektywnej
odpowiedzi na leczenie i czasu do zgonu. Nie stwierdzono istotnej statystycznie różnicy w żadnym z punktów końcowych badania w obu badanych grupach.
Pierwszorzędowym punktem końcowym badania był czas wolny od progresji choroby. Analiza łączna wyników uzyskanych w obu badaniach wykazała, że u 83% pacjentek otrzymujących fulwestrant obserwowano progresję w porównaniu z 85% pacjentek otrzymujących anastrozol. Analiza łączna wyników uzyskanych w obu badaniach wykazała, że współczynnik ryzyka dla porównania fulwestrantu 250 mg do anastrozolu pod względem czasu wolnego od progresji choroby wynosi 0,95 (95,14% CI 0,82 do 1,10). Obiektywny odsetek odpowiedzi dla fulwestrantu w dawce 250 mg wynosił 19,2% w porównaniu z 16,5% dla anastrozolu. Mediana czasu do wystąpienia zgonu wynosiła 27,4 miesiąca dla pacjentek leczonych fulwestrantem i 27,6 miesiąca dla pacjentek leczonych anastrozolem. Współczynnik ryzyka dla porównania fulwestrantu w dawce 250 mg do anastrozolu pod względem czasu do wystąpienia zgonu wynosił 1,01 (95% CI 0,86 do 1,19).
Leczenie skojarzone palbocyklibem
Przeprowadzono międzynarodowe, randomizowane, podwójnie zaślepione, wieloośrodkowe badanie III fazy w grupach równoległych, porównujące leczenie fulwestrantem w dawce 500 mg w skojarzeniu z palbocyklibem w dawce 125 mg z leczeniem fulwestrant w dawce 500 mg w skojarzeniu z placebo u kobiet z hormonozależnym rakiem piersi, bez nadmiernej ekspresji HER2, miejscowo zaawansowanym, niekwalifikującym się do leczenia chirurgicznego ani radioterapii z intencją wyleczenia, lub z rozsianym rakiem piersi, niezależnie od statusu menopauzy, u których doszło do progresji choroby po wcześniejszej terapii hormonalnej w leczeniu (neo) adjuwantowym lub w chorobie rozsianej.
Łącznie 521 kobiet w okresie przed-/około- i pomenopauzalnym, u których doszło do progresji choroby w trakcie lub w ciągu 12 miesięcy od zakończenia uzupełniającej terapii hormonalnej, lub podczas albo w ciągu 1 miesiąca od wcześniejszej terapii hormonalnej z powodu choroby zaawansowanej, zostało losowo przydzielonych w stosunku 2:1 do grupy otrzymującej fulwestrant w skojarzeniu z palbocyklibem lub do grupy otrzymującej fulwestrant w skojarzeniu z placebo.
Randomizację stratyfikowano według udokumentowanej wrażliwości na wcześniejszą terapię hormonalną, okresu menopauzy w chwili przystąpienia do badania (okres przed-/okołomenopauzalny w porównaniu z okresem pomenopauzalnym) i obecności przerzutów do narządów miąższowych.
Kobiety w okresie przed-/okołomenopauzalnym otrzymywały agonistę LHRH, goserelinę. Pacjentki z chorobą zaawansowaną/rozsianą, objawową, z zajęciem narządów miąższowych, u których istniało ryzyko wystąpienia w krótkim czasie powikłań zagrażających życiu (w tym pacjentki z masywnymi niekontrolowanymi wysiękami [opłucnowymi, osierdziowymi, otrzewnowymi], zapaleniem naczyń chłonnych płuc i zajęciem ponad 50% miąższu wątroby) nie spełniały kryteriów włączenia do tego badania.
Pacjentki kontynuowały przydzielone leczenie do chwili wystąpienia obiektywnej progresji choroby, nasilenia objawów, wystąpienia niemożliwych do zaakceptowania objawów toksyczności, zgonu lub wycofania zgody na udział w badaniu, w zależności od tego, które z tych zdarzeń wystąpiło jako pierwsze. Zmiana grup leczenia nie była dozwolona.
Pacjentki z grupy otrzymującej fulwestrant w skojarzeniu z palbocyklibem i pacjentki z grupy otrzymującej fulwestrant w skojarzeniu z placebo były dobrze dobrane pod względem wyjściowych danych demograficznych i cech prognostycznych. Mediana wieku pacjentek włączonych do tego badania wyniosła 57 lat (zakres 29, 88). W każdej grupie badanej większość stanowiły kobiety rasy białej, z udokumentowaną wrażliwością na wcześniejszą terapię hormonalną i w okresie pomenopauzalnym. Około 20% pacjentek stanowiły kobiety w okresie przed-/okołomenopauzalnym. Wszystkie pacjentki otrzymały wcześniej leczenie systemowe i większość pacjentek z każdej grupy terapeutycznej była poddana wcześniej chemioterapii z powodu pierwotnego rozpoznania. U ponad połowy (62%) stan sprawności wg ECOG wyniósł 0, u 60% występowały przerzuty do narządów miąższowych, a 60% otrzymało wcześniej więcej niż 1 linię hormonoterapii z powodu pierwotnego rozpoznania.
Pierwszorzędowym punktem końcowym w badaniu było PFS oceniane przez badacza według kryteriów RECIST 1.1. Wspomagające analizy PFS opierały się na niezależnej, centralnej ocenie
radiologicznej. Drugorzędowe punkty końcowe obejmowały OR, CBR, czas przeżycia całkowitego (OS), bezpieczeństwo stosowania i czas do pogorszenia (ang. time-to-deterioration, TTD) punktu końcowego dotyczącego bólu.
W badaniu osiągnięto pierwszorzędowy punkt końcowy, uzyskano wydłużenie PFS wg oceny badacza w analizie etapowej przeprowadzonej po wystąpieniu 82% planowanych zdarzeń PFS; wyniki przekroczyły predefiniowaną granicę skuteczności Haybittle-Peto (α =0,00135) wykazując statystycznie znamienne wydłużenie PFS i klinicznie znaczący efekt leczenia. Bardziej dojrzałą aktualizację danych dotyczących skuteczności przedstawiono w Tabeli 5.
Po obserwacji o medianie czasu trwania wynoszącej 45 miesięcy przeprowadzono końcową analizę OS na podstawie 310 zdarzeń (60% zrandomizowanych pacjentek). Zaobserwowano różnicę
w medianie OS wynoszącą 6,9 miesiąca między grupą otrzymującą palbocyklib w skojarzeniu z fulwestrantem a grupą otrzymującą placebo w skojarzeniu z fulwestrantem; ten wynik nie był
statystycznie znamienny przy określonym a priori poziomie istotności wynoszącym 0,0235 (test 1 stronny). W grupie leczonej placebo w skojarzeniu z fulwestrantem 15,5% zrandomizowanych
pacjentek otrzymało następnie palbocyklib lub inne inhibitory CDK w ramach kolejnych linii leczenia po progresji choroby.
Wyniki dotyczące danych o PFS według oceny badaczy i końcowych danych o OS w badaniu PALOMA3 przedstawiono w Tabeli 5. Odpowiednie wykresy Kaplana-Meiera pokazano na Rycinach 2 i 3.
Tabela 5. Wyniki dotyczące skuteczności – badanie PALOMA3 (ocena badacza, populacja zgodna z zaplanowanym leczeniem)
Aktualizacja analizy (data odcięcia danych: 23 października 2015 r.) | ||
Fulwestrant plus palbocyklib (N=347) | Fulwestrant plus placebo (N=174) | |
Przeżycie wolne od progresji choroby | ||
Mediana [miesiące (95% CI)] | 11,2 (9,5, 12,9) | 4,6 (3,5, 5,6) |
Współczynnik ryzyka (95% CI) i wartość p | 0,497 (0,398, 0,620), p <0,000001 | |
Drugorzędowe punkty końcowe* | ||
OR [% (95%CI)] | 26,2 (21,7, 31,2) | 13,8 (9,0, 19,8) |
OR (zmiany mierzalne) [% (95% CI)] | 33,7 (28,1, 39,7) | 17,4 (11,5, 24,8) |
CBR [% (95% CI)] | 68,0 (62,8, 72,9) | 39,7 (32,3, 47,3) |
Przeżycie całkowite (OS) w analizie końcowej (data odcięcia danych: 13 kwietnia 2018 r.) | ||
Liczba zdarzeń (%) | 201 (57,9) | 109 (62,6) |
Mediana [miesiące (95% CI)] | 34,9 (28,8, 40,0) | 28,0 (23,6, 34,6) |
Współczynnik ryzyka (95% CI) i wartość p† | 0,814 (0,644, 1,029) P=0,0429† | |
CBR=korzyść kliniczna; CI=przedział ufności; N=liczba pacjentek OR=odpowiedź obiektywna Wyniki dotyczące drugorzędowych punktów końcowych opierają się na potwierdzonych
i niepotwierdzonych odpowiedziach według RECIST 1.1.
* Nieznamienne statystycznie.
† 1-stronna wartość p w logarytmicznym teście rang ze stratyfikacją uwzględniającą obecność przerzutów do narządów trzewnych i wrażliwość na wcześniejszą terapię hormonalną według randomizacji.
Rycina 2. Wykres Kaplana-Meiera dla przeżycia wolnego od progresji choroby (ocena badacza, populacja zgodna z zaplanowanym leczeniem) – badanie PALOMA3
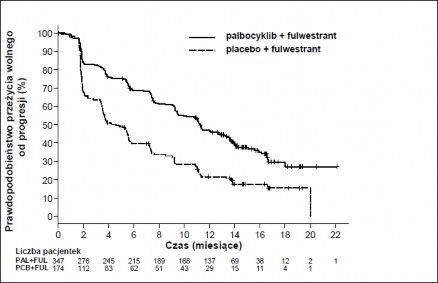
FUL=fulwestrant; PAL=palbocyklib; PCB=placebo.
Redukcja ryzyka progresji choroby lub zgonu w grupie otrzymującej fulwestrant w skojarzeniu
z palbocyklibem obserwowano we wszystkich poszczególnych podgrupach pacjentek definiowanych w oparciu o czynniki stratyfikacji i charakterystykę wyjściową. Redukcję ryzyka wykazano u kobiet w okresie przed-/okołomenopauzalnym (HR=0,46 [95% CI: 0,28; 0,75]), u kobiet w okresie
pomenopauzalnym (HR=0,52 [95% CI: 0,40; 0,66]), u pacjentek z lokalizacją przerzutów w narządach miąższowych (HR=0,50 [95% CI: 0,38; 0,65]) i lokalizacją przerzutów poza narządami miąższowymi (HR=0,48 [95% CI: 0,33; 0,71]). Korzyści również obserwowano niezależnie od liczby linii wcześniejszych terapii z powodu choroby rozsianej, niezależnie od tego, czy było to 0 (HR=0,59 [95% CI: 0,37; 0,93]), 1 (HR=0,46 [95% CI: 0,32; 0,64]), 2 (HR=0,48 [95% CI: 0,30; 0,76]) lub ≥3 linie
leczenia (HR=0,59 [95% CI: 0,28; 1,22]).
Rycina 3. Wykres Kaplana-Meiera dla przeżycia całkowitego (populacja zgodna z zaplanowanym leczeniem) – badanie PALOMA3 (data odcięcia danych: 13 kwietnia 2018 r.)
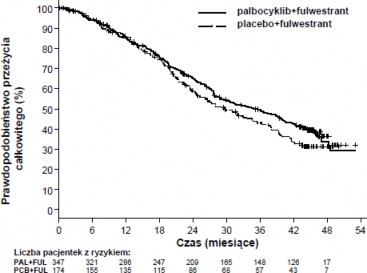
FUL-fulwestrant; PAL=palbocyklib; PCB=placebo.
Dodatkowe miary skuteczności (OR i TTR) oceniane w podgrupach pacjentek z zajęciem narządów miąższowych lub bez zostały przedstawione w Tabeli 6.
Tabela 6. Wyniki dotyczące skuteczności u pacjentek z zajęciem narządów miąższowych lub bez, w badaniu PALOMA3 (populacja zgodna z zaplanowanym leczeniem)
Przerzuty do narządów miąższowych | Brak przerzutów do narządów miąższowych | |||
Fulwestrant plus palbocyklib (N=206) | Fulwestrant plus placebo (N=105) | Fulwestrant plus palbocyklib (N=141) | Fulwestrant plus placebo (N=69) | |
OR [% (95% | 35,0 | 13,3 | 13,5 | 14,5 |
CI)] | (28,5, 41,9) | (7,5, 21,4) | (8,3, 20,2) | (7,2, 25,0) |
TTR*, mediana | 3,8 | 5,4 | 3,7 | 3,6 |
[miesiące | (3,5, 16,7) | (3.5, 16,7) | (1,9, 13,7) | (3,4, 3,7) |
(zakres)] | ||||
*Wyniki dotyczące odpowiedzi na leczenie na podstawie potwierdzonych i niepotwierdzonych odpowiedzi.
N=liczba pacjentek; CI=przedział ufności; OR= odpowiedź obiektywna; TTR=czas do pierwszej odpowiedzi ze strony guza.
Objawy zgłaszane przez pacjentki były oceniane za pomocą kwestionariusza jakości życia (QLQ)-C30 Europejskiej Organizacji na rzecz Badań i Leczenia Raka (EORTC) i jego modułu dotyczącego raka piersi (EORTC QLQ-BR23). Łącznie 335 pacjentek z grupy otrzymującej fulwestrant w skojarzeniu
z palbocyklibem i 166 pacjentek w grupie otrzymującej fulwestrant w skojarzeniu z placebo wypełniło kwestionariusz przy rozpoczęciu badania i przynajmniej 1 raz na wizycie po rozpoczęciu udziału
w badaniu.
Czas do pogorszenia objawów został wcześniej określony jako czas między wynikiem wyjściowym
a pierwszym wystąpieniem zwiększenia o ≥10 punktów w wynikach dotyczących objawów bólowych względem stanu wyjściowego. Dołączenie palbocyklibu do leczenia fulwestrantem miało korzystny wpływ na objawy przez istotne wydłużenie czasu do nasilenia objawów bólowych w porównaniu
z leczeniem fulwestrantem w skojarzeniu z placebo (mediana 8,0 miesięcy w porównaniu z 2,8 miesiąca; HR=0,64 [95% CI: 0,49; 0,85]; p<0,001).
Wpływ na endometrium w okresie po menopauzie
Na podstawie wyników badań nieklinicznych nie można sądzić, że fulwestrant wpływa pobudzająco na błonę śluzową macicy po menopauzie (patrz punkt 5.3). W 2-tygodniowym badaniu klinicznym z udziałem zdrowych ochotniczek po menopauzie stwierdzono, że w porównaniu z placebo leczenie wstępne fulwestrantem w dawce 250 mg powoduje istotne osłabienie działania pobudzającego na błonę śluzową macicy etynyloestradiolu podawanego w dawce 20 mikrogramów. Działanie pobudzające oceniano, mierząc grubość endometrium ultrasonograficznie.
Leczenie neoadjuwantowe u pacjentek z rakiem piersi trwające do 16 tygodni, zarówno fulwestrantem w dawce 500 mg jak i fulwestrantem w dawce 250 mg nie spowodowało znaczącej klinicznie zmiany grubości śluzówki macicy, co wskazuje na brak działania agonistycznego. Nie ma dowodów na niekorzystny wpływ na śluzówkę macicy u badanych pacjentek z rakiem piersi. Nie ma danych dotyczących wpływu na budowę błony śluzowej macicy.
W dwóch krótkotrwałych badaniach klinicznych (trwających 1 i 12 tygodni) przeprowadzonych
u pacjentek w okresie przed menopauzą z łagodnymi schorzeniami ginekologicznymi nie stwierdzono znaczącej różnicy grubości endometrium (mierzonego ultrasonograficznie) między grupą otrzymującą fulwestrant i placebo.
Wpływ na kości
Nie ma danych dotyczących odległych skutków działania fulwestrantu na kości. Leczenie neoadjuwantowe u pacjentek z rakiem piersi trwające do 16 tygodni, zarówno fulwestrantem w dawce 500 mg jak i fulwestrantem w dawce 250 mg nie spowodowało znaczącej klinicznie zmiany
w stężeniach markerów metabolizmu kości w surowicy.
Dzieci i młodzież
Fulvestrant Fresenius Kabi nie jest wskazany do stosowania u dzieci. Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań fulwestrantu we wszystkich podgrupach populacji dzieci i młodzieży we wskazaniu rak piersi (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
W otwartym badaniu klinicznym II fazy oceniano bezpieczeństwo stosowania, skuteczność oraz parametry farmakokinetyczne fulwestrantu, wśród 30 dziewcząt w wieku od 1 do 8 lat
z przedwczesnym dojrzewaniem płciowym (ang. Progressive Precocious Puberty) związanym z zespołem McCune Albrighta (MAS). Dzieci otrzymywały domięśniowo fulwestrant w dawce 4 mg/kg masy ciała co miesiąc. To 12-miesięczne badanie pozwoliło na ocenę wielu punktów
końcowych istotnych dla leczenia MAS i wykazało zmniejszenie częstości krwawień z dróg rodnych oraz zmniejszenie wskaźnika zaawansowania wieku kostnego. W stanie stacjonarnym wartości minimalnych stężeń fulwestrantu ocenione w tym badaniu w osoczu u dzieci odpowiadały wartościom stwierdzanym u pacjentów dorosłych (patrz punkt 5.2). To małe badanie nie ujawniło żadnych nowych doniesień dotyczących bezpieczeństwa stosowania, ale dane z 5–letniej obserwacji nie są jeszcze dostępne.
Wchłanianie
Po podaniu fulwestrantu, w postaci roztworu do wstrzykiwań domięśniowych o długotrwałym działaniu, fulwestrant jest powoli wchłaniany i osiąga maksymalne stężenie w osoczu (Cmax) po mniej więcej 5 dniach. Podawanie fulwestrantu w dawce 500 mg powoduje osiąganie stałych lub
w przybliżeniu stałych wartości ekspozycji przez pierwszy miesiąc stosowania (średnie wartości odpowiednio: AUC 475 [33,4%] ng.dni/ml, Cmax 25,1 [35,3%] ng/ml, Cmin 16,3 [25.9%] ng/ml). W stanie stacjonarnym wartości stężeń fulwestrantu w osoczu mieszczą się w stosunkowo wąskim zakresie, dla którego stężenie maksymalne jest do 3 razy większe niż różnica stężeń w stanie stacjonarnym. Po podaniu domięśniowym w zakresie dawek od 50 do 500 mg, ekspozycja jest
w przybliżeniu proporcjonalnie zależna od dawki.
Dystrybucja
Fulwestrant ulega rozległej i szybkiej dystrybucji w tkankach. Duża pozorna objętość dystrybucji
w stanie stacjonarnym (Vdss) (wynosi około 3 do 5 l/kg), sugeruje, że produkt leczniczy znajduje się głównie w przestrzeni pozanaczyniowej. Fulwestrant wiąże się z białkami osocza w 99%. Fulwestrant wiąże się przede wszystkim z frakcjami lipoprotein o bardzo małej (VLDL), małej (LDL) i dużej gęstości (HDL). Nie badano interakcji dotyczących kompetycyjnego mechanizmu wiązania
z białkami. Nie określono wiązania z globuliną wiążącą hormony płciowe (SHBP).
Metabolizm
Metabolizm fulwestrantu nie został w pełni poznany i zachodzi na drodze wielu przemian biologicznych, w sposób podobny jak w przypadku endogennych steroidów. Wykryte metabolity (włączając 17-keton, sulfoniany, 3-siarczan, 3- i 17-glukuroniany) mają mniejszą niż fulwestrant lub porównywalną z nim aktywność antyestrogenową. W badaniach z wykorzystaniem ludzkich komórek wątroby i rekombinowanych ludzkich enzymów wątrobowych stwierdzono, że CYP 3A4 jest jedynym izoenzymem cytochromu P-450 biorącym udział w procesie oksydacji fulwestrantu, natomiast
w warunkach in vivo główną rolę wydają się pełnić enzymy nienależące do grupy cytochromu P-450. Na podstawie badań in vitro można sądzić, że fulwestrant nie wpływa hamująco na izoenzymy układu cytochromu CYP450.
Eliminacja
Fulwestrant jest wydalany głównie w postaci zmetabolizowanej. Fulwestrant jest wydalany przede wszystkim z kałem, mniej niż 1% jest wydalany w moczu. Fulwestrant ma duży klirens, 11±1,7 ml/min/kg, co może świadczyć o dużym udziale wątroby w wydalaniu leku. Końcowy okres półtrwania (t1/2) po podaniu domięśniowym zależy przede wszystkim od szybkości wchłaniania
i wynosi około 50 dni.
Szczególne grupy pacjentów
Z analizy farmakokinetyki populacyjnej przeprowadzonej na danych pochodzących z badań III fazy wynika, że nie ma różnic w farmakokinetyce fulwestrantu stosowanego u pacjentek z różnych grup wiekowych (pacjentki w wieku 33 do 89 lat), o różnej masie ciała (40-127 kg) lub u różnych ras.
Zaburzenia czynności nerek
Łagodne do umiarkowanych zaburzenia czynności nerek nie wpływają na farmakokinetykę fulwestrantu.
Zaburzenia czynności wątroby
Farmakokinetykę fulwestrantu oceniono w badaniu klinicznym u kobiet z łagodnymi do umiarkowanych zaburzeniami czynności wątroby (grupa A i B według skali Child-Pugh) po podaniu pojedynczej dawki fulwestrantu. W badaniu stosowano dużą dawkę fulwestrantu o krótkim działaniu podawaną domięśniowo. W grupie kobiet z zaburzeniami czynności wątroby obserwowano mniej więcej 2,5-krotne zwiększenie AUC w porównaniu do wartości uzyskanych w grupie zdrowych uczestników badania. Oczekuje się, że takie zwiększenie ekspozycji u pacjentek otrzymujących fulwestrant będzie dobrze tolerowane. Nie badano kobiet z ciężkimi zaburzeniami wątroby (grupa C według skali Child-Pugh).
Dzieci i młodzież
Farmakokinetykę fulwestrantu oceniono w badaniu klinicznym przeprowadzonym wśród 30 dziewcząt w wieku od 1 do 8 lat z przedwczesnym dojrzewaniem płciowym związanym z zespołem McCune Albrighta (patrz punkt 5.1). Pacjentki otrzymywały fulwestrant domięśniowo w dawce 4 mg/kg mc. co miesiąc. Geometryczna mediana (SD) wartości minimalnych stężeń fulwestrantu w osoczu w stanie stacjonarnym (Cmin, ss) i powierzchnia pola pod krzywą AUCss wynosiły odpowiednio: 4,2 (0,9) ng/ml
i 3680 (1020) ng*hr/ml. Pomimo, iż zebrane dane są ograniczone, wartości minimalnych stężeń fulwestrantu w stanie stacjonarnym w osoczu u dzieci wydają się odpowiadać wartościom stwierdzanym u pacjentów dorosłych.
Fulwestrant wykazuje niewielką toksyczność po podaniu jednorazowym (ostrą).
Referencyjny produkt leczniczy oraz inne produkty lecznicze zawierające fulwestrant były dobrze tolerowane przez wszystkie gatunki zwierząt, na których wykonano badania po podaniu wielokrotnym. Reakcje obserwowane w miejscu podania, tj. zapalenie mięśni i ziarniniaki wynikały z działania substancji pomocniczych produktu leczniczego. Jednakże w badaniach przeprowadzonych na królikach zaobserwowano, że zapalenie mięśni było bardziej nasilone w miejscu podania fulwestrantu niż w miejscu podania próbki kontrolnej, która zawierała sól fizjologiczną. Badania przeprowadzone na szczurach i psach wykazały, że po podaniu wielokrotnych dawek fulwestrantu domięśniowo występują objawy związane z jego działaniem antyestrogenowym. Przede wszystkim obserwowano wpływ na żeński układ rozrodczy oraz na te narządy, które są wrażliwe na działanie hormonów u obu płci. U niektórych psów, które przyjmowały fulwestrant przewlekle (12 miesięcy), obserwowano zapalenie tętnic obejmujące różne tkanki.
W badaniach na psach, gdy fulwestrant był podawany doustnie i dożylnie, stwierdzono, że wpływa on na układ sercowo-naczyniowy (niewielkie uniesienie odcinka ST w badaniu EKG [podanie doustne], zahamowanie zatokowe u jednego psa [podanie dożylne]). Reakcje te wystąpiły, gdy stężenia leku stwierdzane u zwierząt były wielokrotnie większe niż stwierdzone u ludzi (Cmax >15 razy). Należy zatem uznać, że ma to niewielkie znaczenie w praktyce klinicznej.
Fulwestrant nie wykazywał działania genotoksycznego.
Wpływ fulwestrantu na reprodukcję i działanie uszkadzające na zarodek i płód, gdy był on podawany w dawkach zbliżonych do dawek terapeutycznych, wynika z jego działania antyestrogenowego.
Fulwestrant podawany szczurom powodował odwracalne zmniejszenie płodności samic i zmniejszone przeżycie zarodków, a także dystocję i zwiększoną ilość różnych zaburzeń u płodu, w tym
patologiczne zgięcie śródstopia. U samic królików, którym podawano fulwestrant występowały poronienia. Obserwowano zwiększoną masę łożyska i obumieranie zarodków po zagnieżdżeniu. Stwierdzono zwiększoną liczbę nieprawidłowości u płodów (w tym wsteczne przesunięcie obręczy miednicy i 27. kręgu przedkrzyżowego).
W dwuletnim badaniu działania rakotwórczego u szczurów (domięśniowe podanie fulwestrantu) wykazano zwiększoną częstość występowania łagodnych ziarniszczaków w jajniku u samic szczurów po podaniu dużych dawek, 10 mg/szczur/15 dni oraz zwiększoną częstość występowania nowotworów z komórek Leydiga w jądrach u samców. Podczas dwuletniego badania rakotwórczości u myszy po podaniu dawek 150 mg/kg/dobę i 500 mg/kg/dobę (doustnie, codziennie) stwierdzono zwiększoną częstość występowania nowotworów sznura płciowego i zrębu jajnika (zarówno łagodnych jak
i złośliwych). Wyniki ekspozycji układowej (AUC), obserwowane po podaniu największej dawki bez obserwowanego działania (NOEL), były u szczurów w przybliżeniu 1,5-krotnością, oczekiwanej ekspozycji u kobiet i 0,8-krotnością ekspozycji u mężczyzn, a u myszy w przybliżeniu 0,8-krotnością, oczekiwanej ekspozycji zarówno u kobiet jak i u mężczyzn. Indukcja takich nowotworów jest związana z farmakologicznymi zaburzeniami hormonalnego sprzężenia zwrotnego dla stężenia gonadotropin, spowodowanymi przez antyestrogeny u zwierząt czynnych rozrodczo. W związku z tym wyniki tych badań nie są uznane za odpowiednie do zalecenia stosowania fulwestrantu w leczeniu zaawansowanego raka piersi u kobiet po menopauzie.
Ocena ryzyka dla środowiska
Badania oceny ryzyka dla środowiska wykazały, że fulwestrant ma potencjał do powodowania działań niepożądanych w środowisku wodnym (patrz punkt 6.6).
Etanol (96%) Alkohol benzylowy Benzylu benzoesan
Olej rycynowy oczyszczony
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonano badań dotyczących zgodności.
2 lata
Przechowywać i przewozić w stanie schłodzonym (2˚C - 8˚C).
Należy ograniczyć przechowywanie produktu leczniczego w temperaturze innej niż 2°C - 8°C. Należy unikać przechowywania w temperaturze wyższej niż 30°C i nie przekraczać okresu 28 dni ze średnią temperaturą przechowywania poniżej 25°C (ale powyżej zakresu 2°C - 8°C). Jeśli zakres temperatur zostanie przekroczony, należy natychmiast zastosować zalecane warunki przechowywania (przechowywać i transportować w lodówce 2°C - 8°C). Przekroczenie właściwej temperatury przechowywania może mieć skumulowany wpływ na jakość produktu leczniczego, a 28-dniowy okres nie może być przekroczony w ciągu 2 lat ważności produktu leczniczego Fulvestrant Fresenius Kabi (patrz punkt 6.3). Ekspozycja na temperaturę poniżej 2°C nie powoduje uszkodzenia produktu leczniczego, jeśli nie jest on przechowywany w temperaturze poniżej -20°C.
Przechowywać ampułko-strzykawkę w oryginalnym opakowaniu w celu ochrony przed światłem.
Fulvestrant Fresenius Kabi składa się z:
Jednej ampułko-strzykawki wykonanej z bezbarwnego szkła (typ I) z tłokiem z polistyrenu zakończonym korkiem z elastomeru, z końcówką zabezpieczającą w tekturowym pudełku, zawierającej 5 ml roztworu fulwestrantu do wstrzykiwań.
W opakowaniu znajduje się również jedna igła z systemem zabezpieczającym (BD SafetyGlide), do podawania produktu leczniczego.
lub:
Dwóch ampułko-strzykawek wykonanych z bezbarwnego szkła (typ I) z tłokami z polistyrenu, zakończonymi korkami z elastomeru, z końcówkami zabezpieczającymi w tekturowym pudełku, zawierającymi po 5 ml roztworu fulwestrantu do wstrzykiwań.
W opakowaniu znajdują się również dwie igły z systemem zabezpieczającym (BD SafetyGlide), do podawania produktu leczniczego.
lub:
Sześciu ampułko-strzykawek wykonanych z bezbarwnego szkła (typ I) z tłokami z polistyrenu, zakończonymi korkami z elastomeru, z końcówkami zabezpieczającymi w tekturowym pudełku, zawierającymi po 5 ml roztworu fulwestrantu do wstrzykiwań.
W opakowaniu znajduje się również sześć igieł z systemem zabezpieczającym (BD SafetyGlide), do podawania produktu leczniczego.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Instrukcja podawania
Należy podawać wstrzyknięcie zgodnie z lokalnymi wytycznymi dotyczącymi wykonywania wstrzyknięć domięśniowych o dużej objętości.
UWAGA: Należy zachować ostrożność, jeśli fulwestrant jest podawany w górno-boczną okolicę pośladka ze względu na bliskość nerwu kulszowego (patrz punkt 4.4).
Uwaga – nie należy umieszczać w autoklawie igły z systemem zabezpieczającym (BD SafetyGlide Shielding Hypodermic Needle) przed jej zastosowaniem. Podczas stosowania produktu leczniczego i usuwania pozostałości należy unikać kontaktu rąk z igłą.
Dotyczy obu strzykawek:
UWAGA: Postępować tak, aby zapewnić bezpieczeństwo sobie i innym. Należy nasłuchiwać kliknięcia i wizualnie potwierdzić, czy końcówka igły jest całkowicie ukryta.
Rysunek 5
Usuwanie pozostałości
Ampułko-strzykawki są przeznaczone wyłącznie do jednorazowego użycia.
Ten produkt leczniczy może stanowić zagrożenie dla środowiska wodnego. Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami (patrz punkt 5.3).
Fresenius Kabi Polska Sp. z o.o. Al. Jerozolimskie 134
02-305 Warszawa
Pozwolenie nr
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











