Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Zapobieganie i leczenie niedoboru witaminy D.
Leczenie krzywicy.
Uzupełnienie właściwego leczenia osteoporozy u pacjentów zagrożonych niedoborem witaminy D.
Dawkowanie i sposób podawania
Noworodki i niemowlęta w pierwszym roku życia: 1 kropla na dobę (= 400 IU) od drugiego tygodnia życia.
Wcześniaki w pierwszym roku życia: 2 krople na dobę (= 800 IU) od drugiego tygodnia życia.
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Stany prowadzące do hiperkalcemii lub hiperkalciurii (pacjenci z zaburzonym wydalaniem wapnia i fosforu, leczenie pochodnymi benzotiadiazyny i pacjenci unieruchomieni).
Kamienie nerkowe zawierające wapń.
Hiperwitaminoza D.
Ciężka miażdżyca.
Ciężkie zaburzenie czynności nerek.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
OlVit D3, 14 400 IU/ml, krople doustne, roztwór
1 ml (36 kropli) zawiera:
14 400 IU (360 μg) cholekalcyferolu (witaminy D3).
Jedna kropla = 400 IU (10 μg) cholekalcyferolu (witaminy D3). Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Krople doustne, roztwór.
Klarowny, bezbarwny do lekko żółtawego, oleisty roztwór.
Dawkowanie
Dawkę indywidualną ustala lekarz prowadzący. Zasadniczo obowiązują następujące wytyczne dotyczące dawkowania:
Zapobieganie niedoborowi witaminy D
Zapobieganie niedoborowi witaminy D | Górny tolerowany poziom spożycia** | ||
Wiek | IU/dobę | krople/dobę | IU/dobę |
0-6 miesięcy* | 400-800 | 1-2 | 1 000 |
6-12 miesięcy* | 400-800 | 1-2 | 1 500 |
1-3 lata* | 400-800 | 1-2 | 2 500 |
4-8 lat | 600-1 000 | 1-3 | 3 000 |
9-18 lat | 600-1 000 | 1-3 | 4 000 |
19-70 lat | 600-1 500 | 1-4 | 4 000 |
70+ | 800-1 500 | 2-4 | 4 000 |
*Poniżej przedstawiono wytyczne dotyczące zapobiegania niedoborowi witaminy D. Profilaktykę rozpoczyna się zwykle od drugiego tygodnia życia, w pierwszym roku życia i przez kolejne dwa lata w okresie niskiego nasłonecznienia. Dzieci (1-3 lat) zagrożone niedoborem podczas miesięcy zimowych (o niskim nasłonecznieniu): 2 krople na dobę (=800 IU). | |||
** W przypadku przekroczenia tej dawki występuje zwiększone ryzyko wystąpienia działań niepożądanych, dlatego produkt leczniczy należy stosować pod nadzorem lekarza.
Leczenie krzywicy
Całkowita potrzebna dawka witaminy D zależy od nasilenia choroby.
W przypadku występującej krzywicy, leczenie rozpoczyna się od dawki 200 000 IU. Następnie, 1 000 do 5 000 IU na dobę (około 2 do 12 kropli produktu leczniczego OlVit D3). W przypadku rozpoczęcia leczenia zaleca się zastosowanie innego produktu leczniczego o wyższej mocy.
Leczenie krzywicy | ||
Wiek | IU/dobę | Krople/dobę |
0-6 miesięcy | Terapia indywidualna! Początkowa dawka 200 000 IU („terapia przerywana”), następnie 1 000 – 5 000 IU na dobę. Do terapii przerywanej zaleca się zastosowanie innego produktu leczniczego o wyższej mocy. | Do terapii przerywanej zaleca się zastosowanie innego produktu leczniczego o wyższej mocy. Następnie: 2-12 |
6-12 miesięcy | ||
1-3 lata | ||
4-8 lat | ||
9-18 lat | ||
Leczenie niedoboru witaminy D
Leczenie niedoboru witaminy D | Górny tolerowany poziom spożycia* | ||
Wiek | IU/dobę | Krople/dobę | IU/dobę |
0-6 miesięcy | Przez 6 tygodni: | Przez 6 tygodni: | 1 000 |
2 000 | 5 | ||
6-12 miesięcy | Następnie: | Następnie: | 1 500 |
400-1 000 | 1 - 3 | ||
1-3 lata | Przez 6 tygodni: | Przez 6 tygodni: | 2 500 |
4-8 lat | 2 000 | 5 | 3 000 |
Następnie: | Następnie: | ||
9-18 lat | 4 000 | ||
600-1 000 | 1 - 3 | ||
19-70 lat | Przez 8 tygodni: | Przez 8 tygodni: | 4 000 |
6 000 | 15 | ||
70+ | Następnie: | Następnie: | 4 000 |
1 500-2 000 | 3 - 5 | ||
* W przypadku przekroczenia tej dawki występuje zwiększone ryzyko wystąpienia działań niepożądanych, dlatego produkt leczniczy należy stosować pod nadzorem lekarza. | |||
Jako uzupełnienie właściwego leczenia osteoporozy u pacjentów zagrożonych niedoborem witaminy D
Jako uzupełnienie właściwego leczenia osteoporozy u pacjentów zagrożonych niedoborem witaminy D | Górny tolerowany poziom spożycia* | |||
IU/dobę | Krople/dobę | Krople/tydzień | IU/dobę | |
Dorośli | 800-1 500 | 2 - 4 | 14-26 | 4 000 |
* W przypadku przekroczenia tej dawki występuje zwiększone ryzyko wystąpienia działań niepożądanych, dlatego produkt leczniczy należy stosować pod nadzorem lekarza. | ||||
Sposób podawania
OlVit D3, krople doustne podaje się bezpośrednio. Najlepiej podawać po kropli do ust lub, jeśli jest to konieczne, w niewielkiej ilości płynu na łyżce.
Poziom niedoboru witaminy D określa się przez pomiar stężenia 25-hydroksywitaminy D (25OHD). U dorosłych stężenie to nie powinno przekraczać 80 ng/ml. Wartości powyżej 150 ng/ml wskazują na przedawkowanie zagrażające zdrowiu pacjenta.
W przypadku długotrwałego stosowania produktu leczniczego OlVit D3, należy regularnie monitorować stężenie wapnia w surowicy i moczu. Jeśli jest to konieczne, dawkę należy dostosować w zależności od stężenia wapnia w surowicy.
W przypadku hiperkalcemii lub oznak zaburzenia czynności nerek należy zmniejszyć dawkę lub przerwać leczenie.
W przypadku długotrwałego stosowania produktu leczniczego OlVit D3 należy monitorować czynność nerek przez pomiar kreatyniny w surowicy. OlVit D3 należy stosować ostrożnie u pacjentów
z zaburzeniem czynności nerek i monitorować wpływ produktu leczniczego na stężenia wapnia i fosforu. Należy wziąć pod uwagę ryzyko zwapnienia tkanek miękkich.
W przypadku ciężkiej niewydolności nerek nie stosuje się cholekalcyferolu. Jeśli jest to wskazane, należy zastosować inne preparaty witaminy D.
Cholekalcyferol należy stosować ostrożnie u pacjentów z sarkoidozą (ryzyko zwiększonej przemiany witaminy D do jej aktywnych metabolitów) i osteoporozą z powodu unieruchomienia (zwiększone ryzyko hiperkalcemii).
OlVit D3 należy stosować ostrożnie u pacjentów leczonych jednocześnie glikozydami nasercowymi i diuretykami tiazydowymi (patrz punkt 4.5).
Dodatkowe dawki witaminy D powinny być stosowane wyłącznie pod nadzorem lekarza. W takich przypadkach należy często kontrolować stężenia wapnia w surowicy i w moczu.
Populacja pediatryczna
Należy unikać jednoczesnego stosowania innych produktów zawierających witaminę D, szczególnie u niemowląt. W razie wątpliwości, lekarz zadecyduje o dodatkowym zastosowaniu żywności wzbogaconej w witaminy lub żywności dla niemowląt i leków zawierających witaminę D.
Wpływ innych produktów leczniczych na cholekalcyferol
Substancje indukujące enzymy metaboliczne CYP450, takie jak ryfampicyna, karbamazepina, fenytoina, barbiturany (np. fenobarbital, prymidon) oraz glikokortykosteroidy, mogą obniżać skuteczność witaminy D z powodu jej zwiększonej inaktywacji. Jednoczesne stosowanie tych produktów leczniczych zwiększa zapotrzebowanie na witaminę D.
Izoniazyd może zmniejszać skuteczność witaminy D3 z powodu zahamowania metabolicznej aktywacji witaminy D.
Produkty lecznicze obniżające wchłanianie tłuszczu, np. orlistat i cholestyramina mogą zaburzać wchłanianie witaminy D.
Zwiększony poziom hormonów przytarczyc może zwiększać metabolizm witaminy D i zwiększać zapotrzebowanie na witaminę D.
Jednoczesne stosowanie glikozydów nasercowych może zwiększać ich toksyczność z powodu hiperkalcemii (ryzyko arytmii). Konieczny jest ścisły nadzór lekarza oraz, jeśli to konieczne, monitorowanie EKG i stężenia wapnia w surowicy.
Jednoczesne stosowanie diuretyków tiazydowych zwiększa ryzyko hiperkalcemii z powodu zmniejszonego wydalania wapnia. Z tego względu należy regularnie monitorować stężenie wapnia w surowicy.
Nie należy stosować leków zawierających magnez (np. środków zobojętniających), gdyż może to prowadzić do hipermagnezemii.
Wpływ cholekalcyferolu na inne leki
Witamina D3 może zwiększać wchłanianie glinu w jelitach.
Ciąża
Dawka dobowa do 400 IU/dobę
Dotychczas nie są znane żadne ryzyka dla podanej dawki. W okresie ciąży należy unikać przedawkowania witaminy D, gdyż hiperkalcemia może prowadzić do opóźnienia rozwoju fizycznego i umysłowego, nadzastawkowego zwężenia aorty i retinopatii u dziecka.
Dawka dobowa powyżej 400 IU/dobę
OlVit D3 należy przyjmować ostrożnie w okresie ciąży i jedynie wtedy, gdy oczekiwana korzyść przewyższa potencjalne ryzyko. W okresie ciąży należy unikać przedawkowania witaminy D, gdyż hiperkalcemia może prowadzić do opóźnienia rozwoju fizycznego i umysłowego, nadzastawkowego zwężenia aorty i retinopatii u dziecka.
Karmienie piersią
Witamina D i jej metabolity przenikają do mleka kobiet karmiących piersią. Nie obserwowano wywołanego w ten sposób przedawkowania u niemowląt. Należy jednak wziąć to pod uwagę, gdy dziecko otrzymuje dodatkową suplementację witaminą D.
Płodność
Brak danych dotyczących wpływu produktu leczniczego OlVit D3 na płodność.
OlVit D3 nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Cholekalcyferol może powodować następujące działania niepożądane, szczególnie w przypadku przedawkowania.
Częstość występowania nieznana (nie może być określona na podstawie dostępnych danych). Zaburzenia metabolizmu i odżywiania:
Hiperkalcemia, hiperkalciuria.
Zaburzenia żołądka i jelit:
Zaparcia, wzdęcia, nudności, ból brzucha, biegunka.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
tel.: +48 22 49 21 301
faks: +48 22 49 21 309
strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie witaminy D może prowadzić do hiperwitaminozy i hiperkalcemii. Hiperwitaminoza objawia się niespecyficznymi objawami takimi jak ból głowy, utrata łaknienia, osłabienie, utrata masy ciała, zaburzenia żołądkowo-jelitowe (nudności, wymioty, zaparcia) i zaburzenia rozwoju.
Utrzymująca się hiperkalcemia może prowadzić do wielomoczu, nadmiernego pragnienia, nudności, wymiotów, zaparć, osłabienia mięśni, niedowładu, osłabienia, moczenia nocnego, białkomoczu, jadłowstrętu, hipercholesterolemii, zwiększonego stężenia transaminaz, zaburzeń rytmu serca, nadciśnienia i zwapnienia tkanek miękkich wykrywalnego w badaniach radiologicznych.
Działanie witaminy D ulega odwróceniu w przypadku ciężkiego przedawkowania. Dochodzi do odwapnienia kości i wzrostu stężenia wapnia we krwi i w moczu. Może dochodzić do wapnienia tkanek, naczyń krwionośnych i nerek. Ponadto mogą wystąpić zaburzenia psychiczne, w tym psychoza.
Leczenie
Należy natychmiast przerwać stosowanie witaminy D i rozpocząć nawadnianie pacjenta w przypadku zatrucia. Pozostałe środki: dieta uboga w wapń, kalcytonina, glikokortykosteroidy.
Grupa farmakoterapeutyczna: witaminy; witamina D i analogi, kod ATC: A11CC05. Mechanizm działania
Witamina D reguluje gospodarkę wapniowo-fosforanową.
Cholekalcyferol oraz w jeszcze większym stopniu produkty jego hydroksylacji indukują tworzenie białka transportującego wapń w błonie śluzowej jelita cienkiego. Prowadzi to do zwiększonego wchłaniania wapnia i fosforanów z jelita. Witamina D stymuluje wchłanianie zwrotne wapnia i fosforu w nerkach.
Niedobór witaminy D prowadzi do krzywicy w rozwijającym się organizmie i do osteomalacji u dorosłych.
Witamina D3 jest uznawana za prekursora hormonów steroidowych ze względu na sposób jej biosyntezy, regulację fizjologiczną i mechanizm działania. Oprócz fizjologicznej produkcji w skórze, cholekalcyferol może być dostarczany z pożywieniem lub jako produkt leczniczy. Ze względu na to,
że w ostatnim przypadku nie dochodzi do hamowania fizjologicznej syntezy skórnej witaminy D, możliwe jest przedawkowanie i zatrucia.
Wchłanianie
Witamina D dobrze wchłania się z przewodu pokarmowego w obecności żółci. W przypadku obniżonego wchłaniania tłuszczu, wchłanianie witaminy D również ulega zmniejszeniu.
Dystrybucja
Witamina D może być magazynowana w wątrobie i tkance tłuszczowej przez długi okres. Działanie cholekalcyferolu jest powolne i długotrwałe.
Metabolizm
Aktywną postacią witaminy D3 jest 1,25-dihydroksycholekalcyferol, który powstaje w wyniku hydroksylacji cholekalcyferolu w wątrobie i nerkach.
Eliminacja
Witamina D i jej metabolity są wydalane głównie z żółcią i kałem. Niewielkie ilości pojawiają się w moczu.
Stwierdzono teratogenne działanie wysokich dawek witaminy D u zwierząt. U potomstwa samic królików, którym w okresie ciąży podawano wysokie dawki witaminy D występowały zmiany podobne do zwężenia zastawki aortalnej. Ponadto u potomstwa, u którego nie występowało zwężenie aorty, zaobserwowano toksyczność naczyniową podobną do występującej u osobników dorosłych po ostrym zatruciu witaminą D.
Cholekalcyferol nie wykazuje właściwości mutagennych ani rakotwórczych.
Triglicerydy kwasów tłuszczowych o średniej długości łańcucha
Nie dotyczy.
Okres ważności: 2 lata.
Okres ważności po pierwszym otwarciu butelki: 10 miesięcy. Wszelkie niewykorzystane resztki produktu leczniczego należy usunąć. Po pierwszym otwarciu nie przechowywać w temperaturze powyżej 25°C.
Nie przechowywać w temperaturze powyżej 30°C.
Przechowywać butelkę w opakowaniu zewnętrznym w celu ochrony przed światłem. Warunki przechowywania produktu leczniczego po pierwszym otwarciu, patrz punkt 6.3.
Butelka z brunatnego szkła typu III o pojemności 15 ml zawierająca 12,5 ml kropli doustnych lub o pojemności 25 ml zawierająca 25 ml kropli doustnych, z zakrętką z PE z pierścieniem gwarancyjnym oraz kroplomierzem z PE, w tekturowym pudełku.
Wielkości opakowania:
1 x 12,5 ml (co odpowiada 450 kroplom)
1 x 25 ml (co odpowiada 900 kroplom)
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
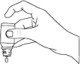
W celu pobrania zawartości należy trzymać butelkę pionowo i delikatnie uderzać palcem w dno butelki aż pojawi się pierwsza kropla.
Bez specjalnych wymagań dotyczących usuwania.
Fresenius Kabi Polska Sp. z o.o. Al. Jerozolimskie 134
02-305 Warszawa
Pozwolenie nr
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











