Spis treści:
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
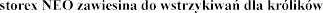
Ca
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
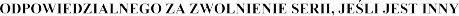
Podmiot odpowiedzialny i wytwórca odpowiedzialny za zwolnienie serii: PHARMAGAL-BIO spol. s r.o.
Murgašova 5
94901 Nitra
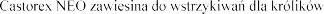
3.  -CH) I INNYCH SUBSTANCJI
-CH) I INNYCH SUBSTANCJI
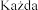
dawka szczepionki (0,5 ml) zawiera:
Substancja czynna:
Inaktywowany wirus krwotocznej choroby królików typ 2, szczep RHDV2 F/12B min. 0,300 O.D.*
Adiuwant:
Glinu wodorotlenek  max. 1,5 mg
max. 1,5 mg
Substancje pomocnicze:
Formaldehyd max. 0,25 mg
Tiomersal max. 0,06 mg
 ELISA w surowicach królików po szczepieniu
ELISA w surowicach królików po szczepieniu
Zawiesina o czerwono-
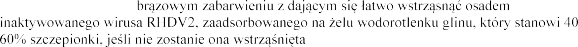
–
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
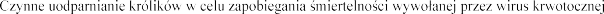
choroby królików RHDV typ 2.
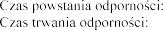
7 dni
1 rok
Brak
6. 

.
-
-
-
-
leczonych
,
,
, ale mniej n
- bardzo rzadko (mniej
leczonych
leczonych leczonych
leczonych
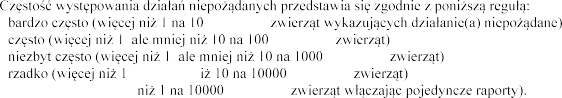
W razie zaobserwowania
lub w przypadku podejrzenia braku dzia
, poinformuj o tym lekarza weterynarii.
,
{www.urpl.gov.pl}.
7.
Królik
8. 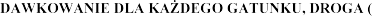 -I) I SPOSÓB PODANIA
-I) I SPOSÓB PODANIA
Dawka szczepionki dla wszystkich grup wiekowych wynosi 0,5 ml.
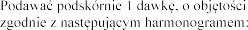
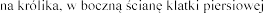
0,5 ml,
Pierwsze szczepienie:
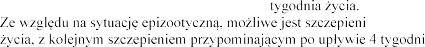
Jednokrotne podanie królikom w wieku od 6.
e królików w wieku od 4. tygodnia
Jednokrotne podanie co
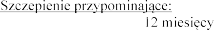
9.
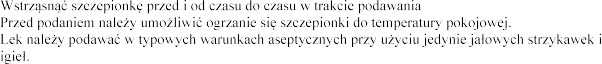
OKRES(-Y) KARENCJI
SPECJALNE
SPECJALN
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI.
INNE INFORMACJE
Zero dni.
°C – 8°C).
.
C
opakowania: 10 godzin

a
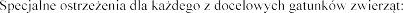
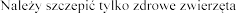
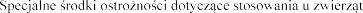
: Nie dotyczy
:
:
tymi
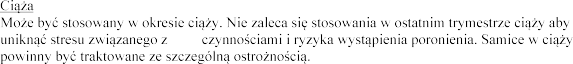

Laktacja:

Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
 i
i  tym samym dniu, co inaktywowana szczepionka RHDV typu 1 (Castorex) u królików w wieku od 10.
tym samym dniu, co inaktywowana szczepionka RHDV typu 1 (Castorex) u królików w wieku od 10.
szczepieniu.
ukcie Castorex.
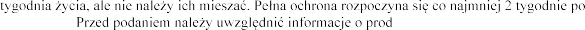
i
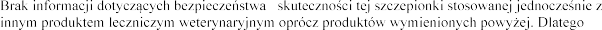
decyzja o zastosowaniu tej szczepionki przed lub po podaniu innego produktu leczniczego
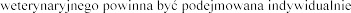
:
“.
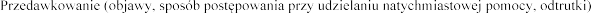
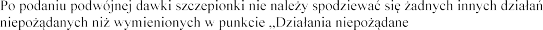
:
leczniczymi weterynaryjnymi.
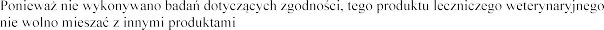
1 x 10 dawek
1 x 20 dawek
1 x 40 dawek
10 x 1 dawka
ne w obrocie.











