Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES(-Y) KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
- INNE INFORMACJE
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA:
Metrotab vet. Flavoured 500 mg tabletki dla psów i kotów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRES(-Y) KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
INNE INFORMACJE
Podmiot odpowiedzialny i wytwórca odpowiedzialny za zwolnienie serii:
CP-Pharma Handelsgesellschaft mbH Ostlandring 13
31303 Burgdorf Niemcy
Metrotab vet. Flavoured 500 mg tabletki dla psów i kotów Metronidazol
Każda tabletka zawiera:
Substancja czynna:
Metronidazol 500 mg
Prawie biała do jasnobrązowej z brązowymi plamkami, okrągła i wypukła tabletka aromatyzowana z linią podziału w kształcie krzyża po jednej stronie.
Tabletki mogą być dzielone na 2 lub 4 równe części.
Leczenie zakażeń przewodu pokarmowego wywołanych przez Giardia spp. oraz Clostridia spp. (tj. C. perfringens lub C. difficile).
Leczenie zakażeń układu moczowo-płciowego, jamy ustnej, gardła i skóry, wywołanych przez bakterie bezwzględnie beztlenowe (np. Clostridia spp.) wrażliwe na metronidazol.
Nie stosować w przypadku zaburzeń czynności wątroby.
Nie stosować w przypadkach nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
Po podaniu metronidazolu mogą wystąpić następujące działania niepożądane: wymioty, hepatotoksyczność oraz neutropenia. W bardzo rzadkich przypadkach mogą wystąpić objawy neurologiczne. U psów najczęściej zgłaszanymi objawami neurologicznymi były: ataksja (móżdżkowo-przedsionkowa) oraz oczopląs (pionowy).
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
Można również zgłosić działania niepożądane poprzez krajowy system raportowania (www.urpl.gov.pl).
Psy i koty.
Sposób podania
Podanie doustne.
Dawkowanie
Zalecana dawka wynosi 50 mg metronidazolu na kg masy ciała (jedna tabletka 500 mg / 10 kg masy ciała) dziennie, przez 5–7 dni. Najlepiej jest dzielić dzienną dawkę na dwie równe porcje, do podawania dwa razy dziennie (tj. 25 mg/kg masy ciała dwa razy dziennie).
Aby zapewnić podanie prawidłowej dawki, należy jak najdokładniej określić masę ciała.
Liczba tabletek | |||
Dwa razy dziennie | Raz dziennie | ||
Masa ciała (kg) | Rano | Wieczorem | |
2,5 kg | ¼ | ||
5 kg | ¼ | ¼ | ½ |
10 kg | ½ | ½ | 1 |
15 kg | ¾ | ¾ | 1 ½ |
20 kg | 1 | 1 | 2 |
25 kg | 1 ¼ | 1 ¼ | 2 ½ |
30 kg | 1 ½ | 1 ½ | 3 |
35 kg | 1 ¾ | 1 ¾ | 3 ½ |
40 kg | 2 | 2 | 4 |
Tabletki można podzielić na 2 lub 4 równe części, aby zapewnić dokładne dawkowanie. Umieścić tabletkę na płaskiej powierzchni, stroną z linią podziału do góry, a wypukłą (zaokrągloną) stroną skierowaną do powierzchni.
Połówki: nacisnąć kciukami lub palcami na brzegi tabletki po obu stronach. Ćwiartki: nacisnąć kciukiem lub palcem na środek tabletki.
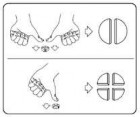
Podzielone tabletki powinny zostać wykorzystane przy następnym podaniu.
Wszelkie podzielone tabletki pozostałe po ostatnim podaniu produktu należy wyrzucić.
Nie dotyczy.
Należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Wszelkie pozostałe części tabletek należy umieścić z powrotem w blistrze i powinny zostać wykorzystane przy następnym podaniu.
Brak specjalnych środków ostrożności dotyczących przechowywania produktu leczniczego weterynaryjnego.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na opakowaniu tekturowym i blistrze po upływie EXP. Termin ważności oznacza ostatni dzień danego miesiąca.
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt:
Brak.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Z powodu prawdopodobnej zmienności (czasowej, geograficznej) występowania oporności bakterii na metronidazol, zalecane jest pobieranie próbek bakteriologicznych oraz oznaczenie lekowrażliwości. W miarę możliwości, produkt należy stosować wyłącznie w oparciu o badanie wrażliwości.
Podczas stosowania produktu leczniczego weterynaryjnego należy uwzględniać oficjalne, krajowe i regionalne wytyczne dotyczące stosowania leków przeciwbakteryjnych.
Po długotrwałym leczeniu metronidazolem mogą wystąpić objawy neurologiczne.
Z uwagi na to, że tabletki są aromatyzowane, należy przechowywać je w miejscu niedostępnym dla zwierząt, aby uniknąć przypadkowego spożycia.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Metronidazol wykazuje potwierdzone właściwości mutagenne i genotoksyczne, zarówno u zwierząt laboratoryjnych, jak i u ludzi. Potwierdzono, że metronidazol ma działanie rakotwórcze na zwierzęta laboratoryjne i ma potencjalne działanie rakotwórczo u ludzi. Niemniej nie ma wystarczających dowodów potwierdzających karcinogenne działanie metronidazolu u ludzi.
Metronidazol może mieć szkodliwy wpływ na nienarodzone dziecko.
Kobiety w ciąży powinny zachować ostrożność przy postępowaniu z tym produktem leczniczym weterynaryjnym.
Podczas stosowania produktu należy używać nieprzepuszczalnych rękawic, aby uniknąć kontaktu produktu ze skórą oraz zapobiec przeniesieniu z dłoni do ust.
Aby uniknąć przypadkowego spożycia, szczególnie przez dziecko, niewykorzystane części tabletek należy umieścić z powrotem w otwartym miejscu w blistrze, a następnie włożyć blister do opakowania
zewnętrznego i przechowywać w bezpiecznym miejscu, niewidocznym i niedostępnym dla dzieci. Po przypadkowym połknięciu, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Metronidazol może powodować reakcje nadwrażliwości. W przypadku znanej nadwrażliwości na metronidazol należy unikać kontaktu z produktem leczniczym weterynaryjnym.
Po kontakcie z tabletkami należy dokładnie myć ręce.
Ciąża i laktacja:
Badania na zwierzętach laboratoryjnych nie dały jednoznacznych wyników w odniesieniu do teratogennego/embiotoksycznego działania metronidazolu. Z tego względu stosowanie produktu w czasie ciąży nie jest zalecane.
Metronidazol przenika do mleka, dlatego stosowanie podczas laktacji nie jest zalecane. Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Metronidazol może mieć hamujący wpływ na rozkład innych leków w wątrobie, takich jak fenytoina,
cyklosporyna i warfaryna.
Cymetydyna może spowalniać metabolizm metronidazolu w wątrobie, co może prowadzić do zwiększenia stężenia metronidazolu w surowicy.
Fenobarbital może przyspieszać metabolizm metronidazolu w wątrobie, co może prowadzić do zmniejszenia stężenia metronidazolu w surowicy.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki): Wystąpienie działań niepożądanych jest bardziej prawdopodobne przy zastosowaniu dawek i czasu trwania leczenia przekraczających zalecany schemat leczenia. W przypadku wystąpienia objawów neurologicznych należy przerwać leczenie, a pacjenta należy leczyć objawowo.
W literaturze opisywano przypadki psów cierpiących na zatrucie metronidazolem, które pomyślnie leczono diazepamem, co skracało czas wyleczenia.
Główne niezgodności:
Nie dotyczy.
O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii lub farmaceutę. Pomogą one chronić środowisko.
Wielkości opakowań:
Pudełko tekturowe zawierające 2 blistry po 10 tabletek Pudełko tekturowe zawierające 3 blistry po 10 tabletek Pudełko tekturowe zawierające 5 blistrów po 10 tabletek Pudełko tekturowe zawierające 10 blistrów po 10 tabletek
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.











