Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
etanol (96%) (100 mg/ml)
alkohol benzylowy (100 mg/ml)
benzylu benzoesan (150 mg/ml)
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
wcześniej niepoddawanych leczeniu hormonalnemu lub
z nawrotem choroby w trakcie lub po zakończeniu leczenia uzupełniającego produktem leczniczym zawierającym antyestrogen, lub z progresją choroby podczas leczenia antyestrogenem.
w skojarzeniu z palbocyklibem w leczeniu miejscowo zaawansowanego lub rozsianego raka piersi z obecnością receptorów hormonalnych (ang. hormone receptor, HR), bez nadmiernej ekspresji receptora ludzkiego naskórkowego czynnika wzrostu 2 (ang. human epidermal growth factor receptor 2, HER2) u kobiet, które wcześniej otrzymały leczenie hormonalne (patrz punkt 5.1).
U kobiet przed menopauzą lub w okresie okołomenopauzalnym leczenie skojarzone z palbocyklibem należy stosować jednocześnie z agonistą hormonu uwalniającego hormon luteinizujący
(ang. luteinizing hormone releasing hormone, LHRH).
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do
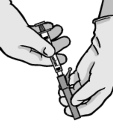
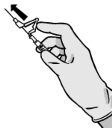
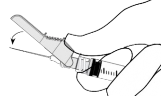
Ostrożnie wyjąć igłę i strzykawkę z opakowania.
Zdjąć zabezpieczenie z końcówki strzykawki.
Otworzyć opakowanie zewnętrzne igły (BD SafetyGlide). Dołączyć igłę do końcówki Luer-Lock.
Dokręcić w celu trwałego umocowania z łącznikiem Luer.
Przez pociągnięcie zdjąć osłonę z igły tak, aby nie uszkodzić jej
Zdjąć nasadkę z igły.
Trzymając strzykawkę igłą do góry delikatnie naciskać tłok, aby wprowadzić lek w górę strzykawki. W strzykawce nie powinno być
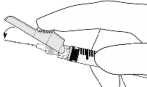
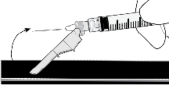
Lek podawać powoli domięśniowo (wstrzyknięcie trwające 1-2 min), w mięsień pośladkowy. Dla wygody osoby podającej lek ścięcie igły znajduje się na tej samej powierzchni igły, co dźwignia systemu
Natychmiast po podaniu leku uruchomić (aktywować) system osłaniający igłę przez popchnięcie palcem do przodu jego dźwigni.
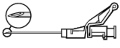
Ostrożnie wyjąć igłę i strzykawkę z opakowania.
Zdjąć zabezpieczenie z końcówki strzykawki.
Połączyć igłę ze strzykawką zachowując jałowość. Trzymając podstawę igły (nie osłonę) przekręcić strzykawkę zgodnie z kierunkiem wskazówek zegarka.
Uchylić osłonę ochronną od igły w kierunku strzykawki (pod wskazanym na rysunku kątem). Następnie zdjąć nasadkę z igły.
Trzymając strzykawkę igłą do góry delikatnie naciskać tłok, aby wprowadzić lek w górę strzykawki. W strzykawce nie powinno być powietrza.
Lek podawać powoli domięśniowo (wstrzyknięcie trwające 1-2 min),
Po zakończeniu wstrzyknięcia wysunąć igłę ze skóry i uruchomić (aktywować) system osłaniający igłę, stosując jedną z trzech metod:
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Fulvestrant Sandoz, 250 mg/5 ml, roztwór do wstrzykiwań w ampułko-strzykawce
Jedna ampułko-strzykawka zawiera 250 mg fulwestrantu (Fulvestrantum) w 5 ml roztworu. Substancje pomocnicze o znanym działaniu:
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań w ampułko-strzykawce Przezroczysty, bezbarwny do żółtego, lepki roztwór.
Produkt Fulvestrant Sandoz jest wskazany:
u kobiet po menopauzie w monoterapii raka piersi z obecnymi receptorami estrogenowymi, miejscowo zaawansowanego lub z przerzutami:
Dorosłe pacjentki (także w podeszłym wieku)
Zalecana dawka wynosi 500 mg podawanych w odstępach jednomiesięcznych z dodatkową dawką
500 mg podaną po 2 tygodniach od podania pierwszej dawki.
Jeśli produkt leczniczy Fulvestrant Sandoz stosuje się w skojarzeniu z palbocyklibem, należy zapoznać się z Charakterystyką Produktu Leczniczego palbocyklibu.
Przed rozpoczęciem leczenia i przez cały czas trwania terapii skojarzonej produktem Fulvestrant
Sandoz z palbocyklibem pacjentki w wieku przed- i (lub) okołomenopauzalnym powinny otrzymywać
leczenie agonistami LHRH, zgodnie z lokalnie przyjętą praktyką kliniczną.
Zaburzenia czynności nerek
Zmiany dawki u pacjentek z lekkimi do umiarkowanych zaburzeniami czynności nerek (klirens kreatyniny ≥30 ml/min) nie są zalecane. U pacjentek z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny <30 ml/min) nie oceniano skuteczności i bezpieczeństwa stosowania, dlatego zaleca się ostrożność podczas stosowania w tej grupie pacjentek (patrz punkt 4.4).
Zmiany dawki u pacjentek z lekkimi do umiarkowanych zaburzeniami czynności wątroby nie są zalecane. Jednak u pacjentek tej grupy produkt Fulvestrant Sandoz należy stosować ostrożnie ze względu na możliwość zwiększonej ekspozycji na fulwestrant. Brak danych dotyczących stosowania produktu u pacjentek z ciężkimi zaburzeniami czynności wątroby (patrz punkty 4.3, 4.4 i 5.2).
Nie ustalono bezpieczeństwa stosowania i skuteczności produktu Fulvestrant Sandoz u dzieci w wieku od urodzenia do 18 lat. Obecnie dostępne dane są opisane w punktach 5.1 i 5.2, ale niemożliwe jest określenie zaleceń dotyczących dawkowania.
Sposób podawania
Fulvestrant Sandoz należy podawać w dwóch kolejnych powolnych wstrzyknięciach domięśniowych po 5 ml (czas jednego wstrzyknięcia 1-2 minuty), po jednym w każdy pośladek.
Należy zachować ostrożność podczas podawania produktu leczniczego Fulvestrant Sandoz
w górnoboczną okolicę pośladka ze względu na bliskość nerwu kulszowego. Szczegółowa instrukcja podawania, patrz punkt 6.6.
Nadwrażliwość na fulwestrant lub na którąkolwiek substancję pomocniczą wymienioną
w punkcie 6.1.
Ciąża i karmienie piersią (patrz punkt 4.6).
Ciężkie zaburzenia czynności wątroby (patrz punkty 4.4 i 5.2).
Produkt Fulvestrant Sandoz należy stosować ostrożnie u pacjentek z lekkimi do umiarkowanych zaburzeniami czynności wątroby (patrz punkt 4.2, 4.3 i 5.2).
Produkt Fulvestrant Sandoz należy stosować ostrożnie u pacjentek z ciężkimi zaburzeniami czynności
nerek (klirens kreatyniny mniejszy niż 30 ml/min).
Ze względu na domięśniową drogę podania, Fulvestrant Sandoz należy stosować ostrożnie u pacjentek ze skazą krwotoczną, małopłytkowością lub stosujących leki przeciwzakrzepowe.
U pacjentek z zaawansowanym rakiem piersi często występują zaburzenia zatorowo-zakrzepowe. Obserwowano je także podczas badań klinicznych z zastosowaniem fulwestrantu (patrz punkt 4.8). Należy wziąć to pod uwagę przepisując produkt Fulvestrant Sandoz pacjentkom z grupy ryzyka.
Wstrzyknięcie fulwestrantu może spowodować reakcje w miejscu podania, w tym zapalenie nerwu kulszowego, nerwoból, ból neuropatyczny i obwodową neuropatię. Należy zachować ostrożność podczas podawania fulwestrantu w górnoboczną okolicę pośladka ze względu na bliskość nerwu kulszowego (patrz punkty 4.2 i 4.8).
Brak danych dotyczących odległych skutków działania fulwestrantu na kości. Ze względu na jego mechanizm działania, istnieje potencjalne ryzyko osteoporozy.
Nie badano skuteczności i bezpieczeństwa stosowania produktu Fulvestrant Sandoz (w monoterapii lub w skojarzeniu z palbocyklibem) u pacjentek z masywnymi przerzutami do narządów miąższowych.
Jeśli produkt Fulvestrant Sandoz stosuje się w skojarzeniu z palbocyklibem, należy zapoznać się
z Charakterystyką Produktu Leczniczego palbocyklibu.
Interakcje z testami przeciwciał estradiolu
Ze względu na podobieństwo budowy fulwestrantu i estradiolu, fulwestrant może zakłócać badania estradiolu z wykorzystaniem przeciwciał i powodować fałszywie duże stężenie estradiolu.
Dzieci i młodzież
Nie zaleca się stosowania produktu Fulvestrant Sandoz u dzieci i młodzieży ze względu na brak danych dotyczących bezpieczeństwa stosowania i skuteczności w tej grupie pacjentów (patrz punkt 5.1).
Substancje pomocnicze
Ten produkt leczniczy zawiera etanol, alkohol benzylowy i benzoesan benzylu.
Ten produkt leczniczy zawiera 1000 mg alkoholu (etanolu 96%) na dawkę, co jest równoważne 100 mg/ml (10% w/v). Ilość alkoholu w podanej dawce tego produktu leczniczego jest równoważna 24 ml piwa lub 10 ml wina. Mała ilość alkoholu w tym produkcie leczniczym nie będzie powodowała zauważalnych skutków.
Ten produkt leczniczy zawiera 1000 mg alkoholu benzylowego na podaną dawkę, co odpowiada 100 mg/ml. Alkohol benzylowy może wywoływać reakcje alergiczne.
Podawanie alkoholu benzylowego małym dzieciom wiąże się z ryzykiem ciężkich działań niepożądanych, w tym zaburzeń oddychania (tzw. ”gasping syndrome”).
Zwiększone ryzyko u małych dzieci z powodu kumulacji.
Duże objętości alkoholu benzylowego należy podawać z ostrożnością i tylko w razie konieczności, zwłaszcza u pacjentów z zaburzeniami czynności nerek lub wątroby, z powodu ryzyka kumulacji toksyczności (kwasica metaboliczna).
Ten produkt leczniczy zawiera 1500 mg benzoesanu benzylu w każdej podanej dawce, co odpowiada 150 mg/ml. Benzoesan benzylu może zwiększać ryzyko żółtaczki (zażółcenie skóry i białkówek oczu) u noworodków (do 4. tygodnia życia). Zwiększona bilirubinemia występująca w następstwie wypierania z albuminy może zwiększać ryzyko żółtaczki u noworodków, która może rozwinąć się w żółtaczkę jąder podkorowych mózgu (złogi niesprzężonej bilirubiny w tkance mózgowej).
Kliniczne badanie interakcji z midazolamem (substratem CYP3A4) wykazało, że fulwestrant nie hamuje aktywności CYP3A4. W klinicznych badaniach interakcji z ryfampicyną (induktor CYP3A4) i ketokonazolem (inhibitor CYP3A4) nie wykazano istotnej klinicznie zmiany klirensu fulwestrantu. Z tego względu zmiana dawki fulwestrantu stosowanego jednocześnie z inhibitorami lub induktorami CYP3A4 nie jest konieczna.
Pacjentki w wieku rozrodczym powinny stosować skuteczne metody antykoncepcji podczas leczenia
fulwestrantem i przez 2 lata po przyjęciu ostatniej dawki. enia.
Ciąża
Stosowanie produktu Fulvestrant Sandoz w okresie ciąży jest przeciwwskazane (patrz punkt 4.3).
W badaniach na szczurach i królikach wykazano, że fulwestrant podawany w pojedynczych dawkach
domięśniowych przenika przez łożysko. Badania na zwierzętach wykazały toksyczny wpływ na reprodukcję, w tym zwiększoną liczbę wad u płodów oraz zgonów (patrz punkt 5.3). Jeśli pacjentka zajdzie w ciążę podczas stosowania produktu Fulvestrant Sandoz, należy ją poinformować
o możliwym zagrożeniu dla płodu i ryzyku utraty ciąży.
Karmienie piersią
Karmienie piersią należy przerwać na czas leczenia produktem Fulvestrant Sandoz. Fulwestrant przenika do mleka karmiących samic szczura. Nie wiadomo, czy przenika do mleka kobiecego. Ze względu na możliwość wywołania przez fulwestrant ciężkich działań niepożądanych u karmionego piersią dziecka, stosowanie fulwestrantu w okresie karmienia piersią jest przeciwwskazane (patrz punkt 4.3).
Płodność
Nie badano wpływu produktu Fulvestrant Sandoz na płodność u ludzi.
Fulvestrant Sandoz nie wpływa lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednak pacjentki, u których wystąpi osłabienie (bardzo często notowane podczas stosowania fulwestrantu), powinny zachować szczególną ostrożność podczas prowadzenia pojazdów lub obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Monoterapia
W tym punkcie przedstawiono informacje dotyczące wszystkich działań niepożądanych odnotowanych podczas badań klinicznych, w okresie po wprowadzeniu fulwestrantu do obrotu lub pochodzących ze spontanicznych zgłoszeń. W zbiorczej grupie danych dotyczących stosowania fulwestrantu w monoterapii najczęściej zgłaszanymi działaniami niepożądanymi były odczyny
w miejscu podania, astenia, nudności i zwiększenie aktywności enzymów wątrobowych (AlAT,
AspAT, fosfataza zasadowa).
Przedstawione w tabeli 1 kategorie częstości działań niepożądanych obliczono na podstawie zbiorczych analiz danych dotyczących bezpieczeństwa stosowania fulwestrantu o mocy 500 mg z badań porównujących fulwestrant 500 mg i o mocy 250 mg (badania CONFIRM [badanie
D6997C00002], FINDER 1 [badanie D6997C00004], FINDER 2 [badanie D6997C00006] i NEWEST
[badanie D6997C00003]) lub samego badania FALCON (badanie D699BC00001), w którym porównywano fulwestrant o mocy 500 mg i anastrozol o mocy 1 mg.
Jeśli częstości w zbiorczej analizie bezpieczeństwa i w badaniu FALCON różniły się, przedstawiono częstość największą. Częstości w tabeli 1 podano na podstawie wszystkich zgłoszonych działań niepożądanych fulwestrantu, niezależnie od tego, czy w opinii badacza istniał związek przyczynowy.
Mediana czasu trwania leczenia fulwestrantem o mocy 500 mg w zbiorczej grupie danych (w tym w badaniach wyżej wymienionych oraz w badaniu FALCON) wyniosła 6,5 miesiąca.
Tabelaryczne zestawienie działań niepożądanych
Działania niepożądane zostały podane zgodnie z częstością i klasyfikacją układów i narządów (ang. System Organ Class, SOC). Częstość określono następująco: bardzo często (≥1/10), często (≥1/100 do
<1/10), niezbyt często (≥1/1000 do <1/100). W obrębie każdej z grup o określonej częstości działania niepożądane wymieniono zgodnie ze zmniejszającym się nasileniem.
Tabela 1 Działania niepożądane zgłaszane podczas stosowania fulwestrantu w monoterapii
Działania niepożądane według klasyfikacji układów i narządów oraz częstości | ||
Zakażenia i zarażenia pasożytnicze | Często | Zakażenia dróg moczowych |
Zaburzenia krwi i układu | Często | Zmniejszona liczba płytek krwie |
chłonnego | ||
Zaburzenia układu immunologicznego | Bardzo często | Reakcje nadwrażliwoście |
Niezbyt często | Reakcje anafilaktyczne | |
Zaburzenia metabolizmu i odżywiania | Często | Jadłowstręta |
Zaburzenia układu nerwowego | Często | Ból głowy |
Zaburzenia naczyniowe | Bardzo często | Uderzenia gorącae |
Często | Żylna choroba zakrzepowo-zatorowaa | |
Zaburzenia żołądka i jelit | Bardzo często | Nudności |
Często | Wymioty, biegunka | |
Zaburzenia wątroby i dróg żółciowych | Bardzo często | Zwiększona aktywność enzymów wątrobowych (AlAT, AspAT, fosfataza zasadowa)a |
Często | Zwiększone stężenie bilirubinya | |
Niezbyt często | Niewydolność wątrobyc,f, zapalenie wątrobyf, zwiększona aktywność gamma-GTf | |
Zaburzenia skóry i tkanki podskórnej | Bardzo często | Wysypkae |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Bardzo często | Ból stawów i bóle mięśniowo-szkieletowed |
Często | Ból plecówa | |
Zaburzenia układu rozrodczego i piersi | Często | Krwotok z pochwye |
Niezbyt często | Kandydoza pochwyf, obfite upławyf | |
Zaburzenia ogólne i stany w miejscu podania | Bardzo często | Asteniaa, odczyny w miejscu podaniab |
Często | Neuropatia obwodowae, zapalenie nerwu kulszowegoe | |
Niezbyt często | Krwotok w miejscu podaniaf, krwiak w miejscu podaniaf, , nerwobólc,f |
a Obejmuje działania niepożądane, dla których nie można określić dokładnego udziału fulwestrantu ze
względu na chorobę podstawową.
b Termin “odczyny w miejscu podania” nie obejmuje terminów krwotok z miejsca podania, krwiak w miejscu podania, zapalenie nerwu kulszowego, nerwoból, neuropatia obwodowa.
c Działania nie obserwowano w trakcie dużych badań klinicznych (CONFIRM, FINDER 1, FINDER 2, NEWEST). Częstość obliczono przyjmując górną granicę 95% przedziału ufności dla estymacji w punkcie. Uzyskano wartość 3/560 (gdzie 560 to liczba pacjentów w dużych badaniach klinicznych), co odpowiada kategorii „niezbyt często”.
d Obejmuje: ból stawów, rzadziej bóle mięśniowo-szkieletowe, ból mięśni i ból kończyn.
e Różnice w częstości między zbiorczą analizą bezpieczeństwa a badaniem FALCON.
f Działania niepożądanego nie obserwowano w badaniu FALCON. Opis wybranych działań niepożądanych
Podane niżej opisy opierają się na analizie bezpieczeństwa obejmującej 228 pacjentek, które otrzymały co najmniej jedną (1) dawkę fulwestrantu oraz 232 pacjentek, które otrzymały co najmniej jedną (1) dawkę anastrozolu w badaniu III fazy FALCON.
Ból stawów i bóle mięśniowo-szkieletowe
W badaniu FALCON liczba pacjentek, które zgłosiły działanie niepożądane w postaci bólu stawów
i bólów mięśniowo-szkieletowych, wyniosła w grupie otrzymującej fulwestrant 65 (31,2%) i w grupie otrzymującej anastrozol 48 (24,1%). Spośród 65 pacjentek z grupy otrzymującej fulwestrant 40%
(26/65) zgłaszało ból stawów i bóle mięśniowo-szkieletowe w pierwszym miesiącu leczenia, zaś 66,2% (43/65) pacjentek zgłaszało te bóle w pierwszych 3 miesiącach leczenia. Żadna z pacjentek nie zgłosiła zdarzeń stopnia ≥3 wg CTCAE (ang. Common Terminology Criteria for Adverse Events) lub wymagających zmniejszenia dawki, przerwania podawania dawki leku bądź zakończenia leczenia
z powodu tych działań niepożądanych.
Leczenie skojarzone z palbocyklibem
Ogólny profil bezpieczeństwa fulwestrantu stosowanego w skojarzeniu z palbocyklibem opiera się na
danych uzyskanych od 517 pacjentek z miejscowo zaawansowanym lub rozsianym rakiem piersi z obecnością receptorów hormonalnych, bez nadmiernej ekspresji HER2, uczestniczących
w randomizowanym badaniu PALOMA3 (patrz punkt 5.1). Najczęstszymi (≥20%) działaniami niepożądanymi dowolnego stopnia nasilenia, które zgłaszały pacjentki otrzymujące fulwestrant z palbocyklibem, były: neutropenia, leukopenia, zakażenia, uczucie zmęczenia, nudności,
niedokrwistość, zapalenie jamy ustnej, biegunka, małopłytkowość i wymioty. Najczęstszymi (≥2%) działaniami niepożądanymi o stopniu nasilenia ≥3 były: neutropenia, leukopenia, zakażenia, niedokrwistość, zwiększenie aktywności AspAT, małopłytkowość i uczucie zmęczenia.
W tabeli 2. przedstawiono działania niepożądane z badania PALOMA3.
Mediana czasu trwania ekspozycji na fulwestrant wyniosła 11,2 miesiąca w grupie otrzymującej fulwestrant z palbocyklibem oraz 4,8 miesiąca w grupie otrzymującej fulwestrant i placebo. Mediana czasu trwania ekspozycji na palbocyklib w grupie fulwestrant plus palbocyklib, wyniosła
10,8 miesiąca.
Tabela 2 Działania niepożądane zgłaszane w badaniu PALOMA 3 (N=517)
Klasyfikacja układów i narządów Preferowany termin (PT)a | Fulwestrant + palbocyklib (N=345) | Fulwestrant + placebo (N=172) | ||
Wszystkich stopni (n%) | Stopnia ≥3. (%) | Wszystkich stopni (n%) | Stopnia ≥3. n (%) | |
Zakażenia i zarażenia pasożytnicze | ||||
Bardzo często | ||||
Zakażeniab | 188 (54,5) | 19 (5,5) | 60 (34,9) | 6 (3,5) |
Zaburzenia krwi i układu chłonnego | ||||
Bardzo często | ||||
Neutropeniac | 290 (84,1) | 240 (69,6) | 6 (3,5) | 0 |
Leukopeniad | 207 (60,0) | 132 (38,3) | 9 (5,2) | 1 (0,6) |
Niedokrwistośće | 109 (31,6) | 15 (4,3) | 24 (14,0) | 4 (2,3) |
Małopłytkowośćf | 88 (25,5) | 10 (2,9) | 0 | 0 |
Niezbyt często | ||||
Gorączka neutropeniczna | 3 (0,9) | 3 (0,9) | 0 | 0 |
Zaburzenia metabolizmu i odżywiania | ||||
Bardzo często | ||||
Zmniejszony apetyt | 60 (17,4) | 4 (1,2) | 18 (10,5) | 1 (0,6) |
Zaburzenia układu nerwowego | ||||
Często | ||||
Zaburzenia smaku | 27 (7,8) | 0 | 6 (3,5) | 0 |
Zaburzenia oka | ||||
Często | ||||
Nasilone łzawienie | 25 (7,2) | 0 | 2 (1,2) | 0 |
Niewyraźne widzenie | 24 (7,0) | 0 | 3 (1,7) | 0 |
Suchość oka | 15 (4,3) | 0 | 3 (1,7) | 0 |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | ||||
Często | ||||
Krwawienie z nosa | 25 (7,2) | 0 | 4 (2,3) | 0 |
Zaburzenia żołądka i jelit | ||||
Bardzo często | ||||
Nudności | 124 (35,9) | 2 (0,6) | 53 (30,8) | 1 (0,6) |
Zapalenie jamy ustnejg | 104 (30,1) | 3 (0,9) | 24 (14,0) | 0 |
Biegunka | 94 (27,2) | 0 | 35 (20,3) | 2 (1,2) |
Wymioty | 75 (21,7) | 2 (0,6) | 28 (16,3) | 1 (0,6) |
Zaburzenia skóry i tkanki podskórnej | ||||
Bardzo często | ||||
Łysienie | 67 (19,4) | NA | 11 (6,4) | NA |
Wysypkah | 63 (18,3) | 3 (0,9) | 10 (5,8) | 0 |
Często | ||||
Suchość skóry | 28 (8,1) | 0 | 3 (1,7) | 0 |
Zaburzenia ogólne i stany w miejscu podania | ||||
Bardzo często | ||||
Zmęczenie | 152 (44,1) | 9 (2,6) | 54 (31,4) | 2 (1,2) |
Gorączka | 47 (13,6) | 1 (0,3) | 10 (5,8) | 0 |
Często | ||||
Astenia | 27 (7,8) | 1 (0,3) | 13 (7,6) | 2 (1,2) |
Badania diagnostyczne | ||||
Bardzo często | ||||
Zwiększenie aktywności AspAT | 40 (11,6) | 11 (3,2) | 13 (7,6) | 4 (2,3) |
Często | ||||
Zwiększenie aktywności AlAT | 30 (8,7) | 7 (2,0) | 10 (5,8) | 1 (0,6) |
AlAT=aminotransferaza alaninowa; AspAT=aminotransferaza asparaginianowa; N=liczba pacjentek,
NA=nie dotyczy
a Preferowana terminologia (PT) podana zgodnie z MedDRA 17.1.
b Zakażenia obejmują wszystkie PT, które należą do zakażeń i zarażeń pasożytniczych w klasyfikacji
układów i narządów.
c Neutropenia obejmuje następujące PT: neutropenia, zmniejszona liczba neutrofilów.
d Leukopenia obejmuje następujące PT: leukopenia, zmniejszona liczba krwinek białych.
e Niedokrwistość obejmuje następujące PT: niedokrwistość, zmniejszenie stężenia hemoglobiny, zmniejszenie wartości hematokrytu.
f Małopłytkowość obejmuje następujące PT: małopłytkowość, zmniejszona liczba płytek krwi.
g Zapalenie jamy ustnej obejmuje następujące PT: aftowe zapalenie jamy ustnej, zapalenie czerwieni warg, zapalenie języka, ból języka, owrzodzenie jamy ustnej, zapalenie błony śluzowej, ból jamy ustnej, uczucie dyskomfortu w jamie ustnej i gardle, ból jamy ustnej i gardła, zapalenie jamy ustnej.
h Wysypka obejmuje następujące PT: wysypka, wysypka grudkowo-plamkowa, wysypka ze świądem, wysypka z rumieniem, wysypka grudkowa, zapalenie skóry, trądzikopodobne zapalenie skóry, toksyczne wykwity skórne.
Opis wybranych działań niepożądanych
Neutropenia
U pacjentek otrzymujących fulwestrant w skojarzeniu z palbocyklibem w ramach badania PALOMA3 neutropenię dowolnego stopnia zgłaszano u 290 (84,1%) pacjentek, neutropenię stopnia 3. zgłoszono u 200 (58,0%) pacjentek, a neutropenię 4. stopnia zgłoszono u 40 (11,6%) pacjentek. W grupie otrzymującej fulwestrant i placebo (n=172) neutropenię dowolnego stopnia odnotowano u 6 (3,5%) pacjentek. Nie zgłoszono żadnego przypadku neutropenii 3. i 4. stopnia.
U pacjentek otrzymujących fulwestrant w skojarzeniu z palbocyklibem mediana czasu do wystąpienia
pierwszego epizodu neutropenii dowolnego stopnia nasilenia wyniosła 15 dni (zakres: 13-512), a mediana czasu trwania neutropenii stopnia ≥3 wyniosła 16dni. Gorączkę neutropeniczną odnotowano u 3 (0,9%) pacjentek otrzymujących fulwestrant z palbocyklibem.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać
wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301/faks: + 48 22 49 21 309/strona internetowa: https://smz.ezdrowie.gov.pl Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Istnieją pojedyncze doniesienia o przypadkach przedawkowania u ludzi. W razie przedawkowania zaleca się leczenie podtrzymujące. Badania na zwierzętach nie wskazują, aby stosowanie fulwestrantu w większych dawkach wywoływało objawy inne niż wynikające z bezpośredniego lub pośredniego działania antyestrogenowego (patrz punkt 5.3).
Grupa farmakoterapeutyczna: leki stosowane w terapii hormonalnej, antyestrogeny Kod ATC: L02BA03
Mechanizm działania i działania farmakodynamiczne
Fulwestrant jest kompetycyjnym antagonistą receptora estrogenowego (ER) o powinowactwie porównywalnym z estradiolem. Fulwestrant blokuje troficzne działanie estrogenów bez nawet częściowego działania agonistycznego (estrogenopodobnego). Mechanizm działania polega na zmniejszeniu ilości (down-regulation) białka receptorowego receptora estrogenowego.
W badaniach klinicznych u kobiet po menopauzie z pierwotnym rakiem piersi wykazano, że
w porównaniu z placebo fulwestrant znacząco zmniejsza ilość (down-regulation) białka receptora estrogenowego w guzach zawierających receptory estrogenowe. Stwierdzono także znaczące zmniejszenie ekspresji receptora progesteronowego, co potwierdza brak wewnętrznej aktywności estrogenowej. Wykazano również, że w neoadjuwantowym leczeniu guzów piersi u kobiet po menopauzie fulwestrant w dawce 500 mg w większym stopniu ogranicza ekspresję receptora estrogenowego i markera proliferacji Ki67 niż fulwestrant w dawce 250 mg.
Bezpieczeństwo kliniczne i skuteczność w zaawansowanym raku piersi
Monoterapia
Badanie kliniczne III fazy ukończyło 736 kobiet po menopauzie z zaawansowanym rakiem piersi, z nawrotem w trakcie lub po zakończeniu hormonalnego leczenia uzupełniającego albo z progresją choroby po leczeniu hormonalnym nowotworu zaawansowanego. Badanie objęło 423 pacjentki,
u których nastąpił nawrót albo progresja w trakcie leczenia antyestrogenowego (podgrupa AE) oraz 313 pacjentek z nawrotem lub progresją w trakcie leczenia inhibitorem aromatazy (podgrupa AI). Celem badania było porównanie skuteczności i bezpieczeństwa stosowania fulwestrantu w dawce 500 mg (n=362) i w dawce 250 mg (n=374). Pierwszorzędowym punktem końcowym było przeżycie wolne od progresji choroby (PFS), zaś najważniejsze drugorzędowe punkty końcowe oceniające skuteczność leczenia objęły odsetek odpowiedzi obiektywnych (ORR), wskaźnik korzyści klinicznej (CBR) i całkowite przeżycie (OS). Wyniki badania CONFIRM dotyczące skuteczności leczenia podsumowano w tabeli 3.
Tabela 3 Podsumowanie wyników skuteczności leczenia w badaniu CONFIRM: pierwszorzędowy punkt końcowy (PFS) i najważniejsze drugorzędowe punkty końcowe.
Zmienna | Sposób oceny; porównanie leczenia | Fulwestrant 500 mg (N=362) | Fulwestrant 250 mg (N=374) | Porównanie grup (fulwestrant 500 mg/ fulwestrant 250 mg) | ||
Współczynnik ryzyka | 95% CI | Wartość p | ||||
PFS | Mediana czasu przeżycia [miesiące] wg K-M; współczynnik ryzyka | |||||
Wszystkie pacjentki | 6,5 | 5,5 | 0,80 | 0,68, 0,94 | 0,006 | |
Podgrupa AE (n=423) | 8,6 | 5,8 | 0,76 | 0,62, 0,94 | 0,013 | |
Podgrupa AI (n=313)a | 5,4 | 4,1 | 0,85 | 0,67, 1,08 | 0,195 | |
OSb | Mediana czasu przeżycia [miesiące] wg K-M; współczynnik ryzyka | |||||
Wszystkie pacjentki | 26,4 | 22,3 | 0,81 | 0,69, 0,96 | 0,016c | |
Podgrupa AE (n=423) | 30,6 | 23,9 | 0,79 | 0,63, 0,99 | 0,038c | |
Podgrupa AI (n=313)a | 24,1 | 20,8 | 0,86 | 0,67, 1,11 | 0,241c | |
Zmienna | Sposób oceny; porównanie leczenia | Fulwestrant 500 mg (N=362) | Fulwestrant 250 mg (N=374) | Porównanie grup (fulwestrant 500 mg / fulwestrant 250 mg) | ||
Bezwzględna różnica w % | 95% CI | |||||
ORRd | % pacjentek z OR; bezwzględna różnica w % | |||||
Wszystkie pacjentki | 13,8 | 14,6 | -0,8 | -5,8, 6,3 | ||
Podgrupa AE (n=296) | 18,1 | 19,1 | -1,0 | -8,2, 9,3 | ||
Podgrupa AI (n=205)a | 7,3 | 8,3 | -1,0 | -5,5, 9,8 | ||
CBRe | % pacjentek z CB; bezwzględna różnica w % | |||||
Wszystkie pacjentki | 45,6 | 39,6 | 6,0 | -1,1, 13,3 | ||
Podgrupa AE (n=423) | 52,4 | 45,1 | 7,3 | -2,2, 16,6 | ||
Podgrupa AI (n=313)a | 36,2 | 32,3 | 3,9 | -6,1, 15,2 | ||
a Fulwestrant jest wskazany u pacjentek, u których nastąpił nawrót lub progresja choroby podczas leczenia antyestrogenowego. Wyniki w podgrupie inhibitorów aromatazy nie są rozstrzygające.
b Wartość OS (całkowite przeżycie) dla końcowej analizy przeżycia przy 75% dojrzałości wyników.
c Nominalna wartość p bez korekty poziomu istotności dla testów wielokrotnych (dwa testy: przy
50% i 75% dojrzałości wyników).
d ORR oceniano u pacjentek, które na wstępie zakwalifikowano do grupy podlegającej ocenie odpowiedzi na leczenie (tzn. do grupy pacjentek, u których na początku badania możliwa była ocena wielkości zmian nowotworowych: 240 pacjentek w grupie otrzymującej fulwestrant
w dawce 500 mg i 261 pacjentek w grupie otrzymującej fulwestrant w dawce 250 mg).
e Pacjentki z odpowiedzią obiektywną całkowitą, częściową lub stabilną chorobą ≥24 tygodni.
PFS: przeżycie wolne od progresji choroby; ORR: odsetek odpowiedzi obiektywnych; OR: odpowiedź
obiektywna; CRB: odsetek korzyści klinicznych; CB: korzyść kliniczna; OS: całkowite przeżycie;
K-M: krzywe Kaplana-Meiera; CI: przedział ufności, IA: inhibitory aromatazy; AE: antyestrogeny.
Przeprowadzono randomizowane, wieloośrodkowe, podwójnie pozorowane badanie trzeciej fazy z podwójnie ślepą próbą, porównujące fulwestrant o mocy 500 mg z anastrozolem o mocy 1 mg u kobiet po menopauzie z ER-dodatnim i (lub) PgR-dodatnim miejscowo zaawansowanym lub rozsianym rakiem piersi, które wcześniej nie otrzymywały żadnej terapii hormonalnej. Łącznie
462 pacjentki były sekwencyjnie losowo przydzielane w stosunku 1:1 do grupy otrzymującej 500 mg fulwestrantu lub do grupy otrzymującej 1 mg anastrozolu.
Randomizacja była stratyfikowana według stopnia zaawansowania choroby (miejscowo zaawansowana lub rozsiana), wcześniejszej chemioterapii z powodu zaawansowanej choroby i obecności zmian możliwych do oceny.
Pierwszorzędowym punktem końcowym dotyczącym skuteczności w tym badaniu było przeżycie wolne od progresji choroby (PFS) oceniane przez badacza według kryteriów oceny odpowiedzi na leczenie w guzach litych RECIST 1.1 (ang. Response Evaluation Criteria in Solid Tumours).
Najważniejsze drugorzędowe punkty końcowe oceny skuteczności obejmowały przeżycie całkowite
(OS) i odsetek odpowiedzi obiektywnych (ORR).
Mediana wieku pacjentek włączonych do badania wyniosła 63 lata (zakres 36-90). U większości pacjentek (87,0%) przed rozpoczęciem badania występowały przerzuty; u 55% pacjentek występowały przerzuty do narządów miąższowych. Łącznie 17,1% pacjentek otrzymało wcześniej chemioterapię z powodu choroby zaawansowanej, a u 84,2% pacjentek możliwa była ocena wielkości zmian nowotworowych.
W większości predefiniowanych podgrup pacjentek otrzymane wyniki były spójne. W podgrupie pacjentek z chorobą ograniczoną do przerzutów innych niż przerzuty do narządów miąższowych (n=208) wartość HR wyniosła 0,592 (95% CI: 0,419; 0,837) w grupie otrzymującej fulwestrant w porównaniu z grupą leczoną anastrozolem. W podgrupie pacjentek z przerzutami do narządów
miąższowych (n=254) HR wyniósł 0,993 (95% CI: 0,740; 1,331) w grupie otrzymującej fulwestrant w porównaniu z grupą leczoną anastrozolem. Wyniki dotyczące skuteczności w badaniu FALCON przedstawiono w tabeli 4. i na rycinie 1.
Tabela 4 Podsumowanie wyników dotyczących pierwszorzędowego punktu końcowego oceny skuteczności (PFS) i najważniejszych drugorzędowych punktów końcowych oceny skuteczności (ocena badacza, populacja zgodna z intencją leczenia) w badaniu FALCON
Fulwestrant 500 mg (N=230) | Anastrozol 1 mg (N=232) | |
Przeżycie wolne od progresji choroby | ||
Liczba zdarzeń PFS (%) | 143 (62,2%) | 166 (71,6%) |
Współczynnik ryzyka (95% CI) | HR 0,797 (0,637 – 0,999) | |
Wartość p dla PFS | p = 0,0486 | |
Mediana PFS [miesiące (95% CI)] | 16,6 (13,8, 21,0) | 13,8 (12,0, 16,6) |
Liczba zdarzeń OS* | 67 (29,1%) | 75 (32,3%) |
Współczynnik ryzyka (95% CI) | HR 0,875 (0,629 – 1,217) | |
Wartość p dla OS | p = 0,4277 | |
ORR** | 89 (46,1%) | 88 (44,9%) |
Iloraz szans (95% CI) | OR 1,074 (0,716 – 1,614) | |
Wartość p dla ORR | p = 0,7290 | |
Mediana DoR (miesiące) | 20,0 | 13,2 |
CBR | 180 (78,3%) | 172 (74,1%) |
Iloraz szans (95% CI) | OR 1,253 (0,815 – 1,932) | |
Wartość p dla CBR | p = 0,3045 | |
* (31% dojrzałość danych) - nieostateczna analiza OS
** u pacjentek ze zmianami mierzalnymi
Rycina 1 Wykres Kaplana-Meiera dla przeżycia wolnego od progresji choroby (ocena badacza, populacja zgodna z intencją leczenia) w badaniu FALCON
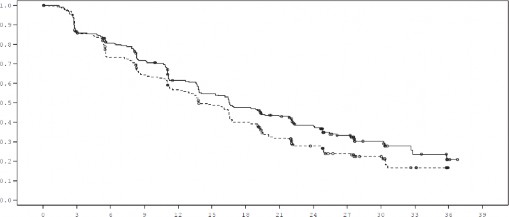
Czas od randomizacji (miesiące)
Leczenie Fulwestrant 500 mg (N=230) Anastrozol 1 mg (N=232)
Liczba pacjentek obarczonych ryzykiem:
FUL500 | 230 | 187 | 171 | 150 | 124 | 110 | 96 | 81 | 63 | 44 | 24 | 11 | 2 | 0 |
ANAS1 | 232 | 194 | 162 | 139 | 120 | 102 | 84 | 60 | 45 | 31 | 22 | 10 | 0 | 0 |
Dwa badania kliniczne III fazy ukończyło 851 kobiet po menopauzie z zaawansowanym rakiem piersi z nawrotem choroby w trakcie lub po zakończeniu hormonalnego leczenia uzupełniającego lub
z progresją choroby podczas leczenia hormonalnego zaawansowanego raka piersi. U 77% pacjentek biorących udział w badaniach wykazano obecność receptora estrogenowego w komórkach raka piersi. W badaniach tych porównywano bezpieczeństwo stosowania i skuteczność fulwestrantu podawanego co miesiąc w dawce 250 mg i anastrozolu (inhibitora aromatazy) podawanego codziennie w dawce
1 mg. Stwierdzono, że fulwestrant w comiesięcznej dawce 250 mg jest co najmniej tak skuteczny, jak anastrozol w odniesieniu do przeżycia wolnego od progresji choroby, obiektywnej odpowiedzi na leczenie i czasu do zgonu. Nie stwierdzono istotnej statystycznie różnicy między obiema grupami
w odniesieniu do żadnego z punktów końcowych badania. Pierwszorzędowym punktem końcowym badania był czas wolny od progresji choroby. Łączna analiza wyników obu badań wykazała, że progresja choroby wystąpiła u 83% pacjentek otrzymujących fulwestrant i u 85% pacjentek otrzymujących anastrozol. W tej analizie współczynnik ryzyka dla porównania fulwestrantu w dawce 250 mg z anastrozolem w odniesieniu do czasu wolnego od progresji choroby wyniósł 0,95 (95% CI 0,82 do 1,10). Odsetek obiektywnych odpowiedzi dla fulwestrantu 250 mg wynosił 19,2%, a dla anastrozolu 16,5%. Mediana czasu do wystąpienia zgonu wynosiła 27,4 miesiąca u pacjentek otrzymujących fulwestrant i 27,6 miesiąca u pacjentek leczonych anastrozolem. Współczynnik ryzyka dla porównania fulwestrantu 250 mg z anastrozolem pod względem czasu do wystąpienia zgonu wynosił 1,01 (95% CI 0,86 do 1,19).
Leczenie skojarzone z palbocyklibem
Przeprowadzono międzynarodowe, wieloośrodkowe, randomizowane, badanie III fazy w grupach
równoległych z podwójnie ślepą próbą, które porównywało leczenie fulwestrantem 500 mg
w skojarzeniu z palbocyklibem w dawce 125 mg z leczeniem fulwestrantem 500 mg w skojarzeniu z placebo u kobiet z hormonozależnym, miejscowo zaawansowanym rakiem piersi bez nadmiernej ekspresji HER2, niekwalifikującym się do leczenia chirurgicznego ani radioterapii z intencją wyleczenia, lub z rozsianym rakiem piersi (niezależnie od statusu menopauzy), u których nastąpiła progresja choroby po wcześniejszej terapii hormonalnej w leczeniu (neo) adjuwantowym lub
w chorobie rozsianej.
Łącznie 521 kobiet w okresie przed-/około- i pomenopauzalnym, u których doszło do progresji choroby po lub w ciągu 12 miesięcy od zakończenia uzupełniającej terapii hormonalnej, lub po albo w ciągu 1 miesiąca od wcześniejszej terapii hormonalnej z powodu choroby zaawansowanej, przydzielono losowo w stosunku 2:1 do grupy otrzymującej fulwestrant w skojarzeniu
z palbocyklibem lub do grupy otrzymującej fulwestrant i placebo. Randomizację stratyfikowano według udokumentowanej wrażliwości na wcześniejszą terapię hormonalną, okresu menopauzy w chwili przystąpienia do badania (okres przed-/okołomenopauzalny w porównaniu z okresem pomenopauzalnym) i obecności przerzutów do narządów miąższowych. Kobiety w okresie przed-
/okołomenopauzalnym otrzymywały goserelinę (agonista LHRH). Pacjentki z chorobą zaawansowaną/rozsianą, objawową, z zajęciem narządów miąższowych i z ryzykiem wystąpienia
w krótkim czasie powikłań zagrażających życiu (w tym pacjentki z masywnymi niekontrolowanymi
wysiękami [opłucnowymi, osierdziowymi, otrzewnowymi], zapaleniem naczyń chłonnych płuc
i zajęciem ponad 50% miąższu wątroby) nie spełniały kryteriów włączenia do tego badania.
Pacjentki kontynuowały przydzielone leczenie do chwili wystąpienia obiektywnej progresji choroby, nasilenia objawów, wystąpienia niemożliwych do zaakceptowania objawów toksyczności, zgonu lub wycofania zgody na udział w badaniu, w zależności od tego, które z tych zdarzeń wystąpiło jako pierwsze. Zmiana grup leczenia nie była dozwolona.
Pacjentki z grupy fulwestrant z palbocyklibem i z grupy fulwestrant z placebo były dobrze dobrane pod względem wyjściowych danych demograficznych i cech prognostycznych. Mediana wieku pacjentek włączonych do badania wyniosła 57 lat (zakres od 29 do 88). W każdej grupie badanej większość stanowiły kobiety rasy białej, z udokumentowaną wrażliwością na wcześniejszą terapię hormonalną i w okresie pomenopauzalnym. Około 20% pacjentek było w okresie przed-
/okołomenopauzalnym. Wszystkie pacjentki otrzymały wcześniej leczenie systemowe, a większość pacjentek z każdej grupy terapeutycznej była poddana wcześniej chemioterapii z powodu pierwotnego rozpoznania. U ponad połowy (62%) stan sprawności wg ECOG wyniósł 0, u 60% występowały przerzuty do narządów miąższowych, a 60% otrzymało wcześniej więcej niż 1 linię hormonoterapii
z powodu pierwotnego rozpoznania.
Pierwszorzędowym punktem końcowym w badaniu było PFS oceniane przez badacza według kryteriów RECIST 1.1. Wspomagające analizy PFS opierały się na niezależnej, centralnej ocenie radiologicznej. Drugorzędowe punkty końcowe obejmowały OR, CBR, czas przeżycia całkowitego (OS), bezpieczeństwo stosowania i czas do pogorszenia (ang. time-to-deterioration, TTD) punktu końcowego dotyczącego bólu.
W badaniu osiągnięto pierwszorzędowy punkt końcowy, uzyskano wydłużenie PFS wg oceny badacza w analizie etapowej przeprowadzonej po wystąpieniu 82% planowanych zdarzeń PFS; wyniki przekroczyły predefiniowaną granicę skuteczności Haybittle-Peto (α=0,00135) wykazując statystycznie znamienne wydłużenie PFS i klinicznie znaczący efekt leczenia. Bardziej dojrzałą aktualizację danych dotyczących skuteczności przedstawiono w tabeli 5.
Po obserwacji o medianie czasu trwania wynoszącej 45 miesięcy przeprowadzono końcową analizę OS na podstawie 310 zdarzeń (60% zrandomizowanych pacjentek). Zaobserwowano różnicę w medianie OS wynoszącą 6,9 miesiąca między grupą otrzymującą palbocyklib w skojarzeniu z fulwestrantem a grupą otrzymującą placebo w skojarzeniu z fulwestrantem; ten wynik nie był statystycznie znamienny przy określonym a priori poziomie istotności wynoszącym 0,0235 (test 1-
stronny). W grupie leczonej placebo w skojarzeniu z fulwestrantem 15,5% zrandomizowanych pacjentek otrzymało następnie palbocyklib lub inne inhibitory CDK w ramach kolejnych linii leczenia po progresji choroby.
Wyniki dotyczące danych o PFS według oceny badaczy i końcowych danych o OS w badaniu PALOMA3 przedstawiono w Tabeli 5. Odpowiednie wykresy Kaplana-Meiera pokazano na Rycinach 2 i 3.
Tabela 5 Wyniki badania PALOMA3 dotyczące skuteczności (ocena badacza, populacja zgodna z intencją leczenia)
Aktualizacja analizy (data ucięcia danych: 23 października 2015 r.) | ||
Fulwestrant + palbocyklib (N=347) | Fulwestrant + placebo (N=174) | |
Przeżycie wolne od progresji choroby | ||
Mediana (miesiące [95% CI]) | 11,2 (9,5, 12,9) | 4,6 (3,5, 5,6) |
Współczynnik ryzyka (95% CI) i wartość p | 0,497 (0,398, 0,620) p <0,000001 | |
Drugorzędowe punkty końcowe* | ||
OR (% [95% CI]) | 26,2 (21,7, 31,2) | 13,8 (9,0, 19,8) |
OR (zmiany mierzalne) (% [95% CI]) | 33,7 (28,1, 39,7) | 17,4 (11,5, 24,8) |
CBR (% [95% CI]) | 68,0 (62,8, 72,9) | 39,7 (32,3, 47,3) |
Przeżycie całkowite (OS) w analizie końcowej (data ucięcia danych: 13 kwietnia 2018 r.) | ||
Liczba zdarzeń (%) | 201 (57,9) | 109 (62,6) |
Mediana [miesiące (95% CI)] | 34,9 (28,8, 40,0) | 28,0 (23,6, 34,6) |
Współczynnik ryzyka (95% CI) i wartość p† | 0.814 (0,644, 1,029) p=0,0429†* | |
CBR= korzyść kliniczna; CI=przedział ufności; N=liczba pacjentek; OR=odpowiedź obiektywna; Wyniki dotyczące drugorzędowych punktów końcowych opierają się na potwierdzonych i niepotwierdzonych odpowiedziach według RECIST 1.1.
* Nieznamienne statystycznie.
†1-stronna wartość p w logarytmicznym teście rang ze stratyfikacją uwzględniającą obecność przerzutów do narządów trzewnych i wrażliwość na wcześniejszą terapię hormonalną według randomizacji.
Rycina 2 Wykres Kaplana-Meiera dla przeżycia wolnego od progresji choroby (ocena badacza, populacja zgodna z intencją leczenia) w badaniu PALOMA3 (data ucięcia danych: 23 października 2015)
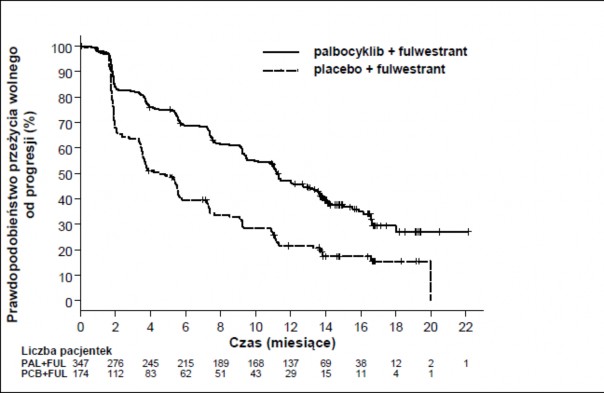
FUL=fulwestrant; PAL=palbocyklib; PCB=placebo
Redukcja ryzyka progresji choroby lub zgonu w grupie otrzymującej fulwestrant z palbocyklibem
obserwowano we wszystkich poszczególnych podgrupach pacjentek definiowanych w oparciu
o czynniki stratyfikacji i charakterystykę wyjściową. Redukcję ryzyka wykazano u kobiet w okresie przed-/okołomenopauzalnym (HR=0,46 [95% CI: 0,28; 0,75]), u kobiet w okresie pomenopauzalnym (HR=0,52 [95% CI: 0,40; 0,66]), u pacjentek z lokalizacją przerzutów w narządach miąższowych (HR=0,50 [95% CI: 0,38; 0,65]) i lokalizacją przerzutów poza narządami miąższowymi (HR=0,48 [95% CI: 0,33; 0,71]). Korzyści obserwowano również niezależnie od liczby linii wcześniejszych terapii z powodu choroby rozsianej, niezależnie od tego, czy było to 0 (HR=0,59 [95% CI: 0,37; 0,93]), 1 (HR=0,46 [95% CI: 0,32; 0,64]), 2 (HR=0,48 [95% CI: 0,30; 0,76]) lub ≥3 linie leczenia
(HR=0,59 [95% CI: 0,28; 1,22]).
Rycina 3 Wykres Kaplana-Meiera dla całkowitego przeżycia (populacja zgodna z intencją leczenia) w badaniu PALOMA3 (data ucięcia danych 13 kwietnia 2018)
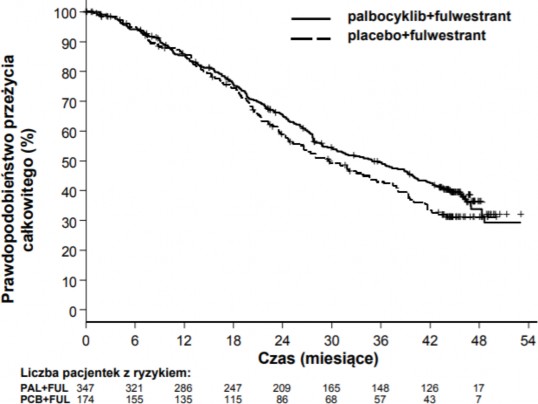
FUL=fulwestrant; PAL=palbocyklib; PCB=placebo
Dodatkowe miary skuteczności (OR i TTR) oceniane w podgrupach pacjentek z zajęciem narządów miąższowych lub bez zostały przedstawione w Tabeli 6.
Tabela 6 Wyniki badania PALOMA3 dotyczące skuteczności u pacjentek z zajęciem narządów miąższowych lub bez (populacja zgodna z intencją leczenia)
Przerzuty do narządów miąższowych | Bez przerzutów do narządów miąższowych | |||
Fulwestrant + palbocyklib (N=206) | Fulwestrant + placebo (N=105) | Fulwestrant + palbocyklib (N=141) | Fulwestrant + placebo (N=69) | |
OR (% [95% CI]) | 35,0 | 13,3 | 13,5 | 14,5 |
(28,5, 41,9) | (7,5, 21,4) | (8,3, 20,2) | (7,2, 25,0) | |
TTR*, mediana | 3,8 | 5,4 | 3.7 | 3,6 |
(miesiące [zakres]) | (3,5, 16,7) | (3,5, 16,7) | (1,9, 13,7) | (3,4, 3,7) |
* Wyniki dotyczące odpowiedzi na leczenie na podstawie potwierdzonych i niepotwierdzonych odpowiedzi.
N=liczba pacjentek; CI=przedział ufności; OR=odpowiedź obiektywna; TTR=czas do pierwszej
odpowiedzi ze strony guza.
Objawy zgłaszane przez pacjentki były oceniane za pomocą kwestionariusza jakości życia (QLQ)-C30 Europejskiej Organizacji na rzecz Badań i Leczenia Raka (EORTC) i jego modułu dotyczącego raka piersi (EORTC QLQ-BR23). Łącznie 335 pacjentek z grupy otrzymującej fulwestrant w skojarzeniu
z palbocyklibem i 166 pacjentek w grupie otrzymującej fulwestrant z placebo wypełniło kwestionariusz przy rozpoczęciu badania i przynajmniej 1 raz na wizycie po rozpoczęciu udziału w badaniu.
Czas do pogorszenia objawów został wcześniej określony jako czas między wynikiem wyjściowym
a pierwszym zwiększeniem względem stanu wyjściowego o ≥10 punktów wyników dotyczących
objawów bólowych. Dołączenie palbocyklibu do leczenia fulwestrantem miało korzystny wpływ na objawy przez istotne wydłużenie czasu do nasilenia objawów bólowych w porównaniu z leczeniem fulwestrantem w skojarzeniu z placebo (mediana 8,0 miesięcy vs 2,8 miesiąca; HR=0,64 [95% CI: 0,49; 0,85]; p<0,001).
Wpływ na endometrium w okresie po menopauzie
Badania niekliniczne nie wskazują, aby fulwestrant miał działanie pobudzające na błonę śluzową macicy po menopauzie (patrz punkt 5.3). Trwające 2 tygodnie badanie kliniczne z udziałem zdrowych ochotniczek po menopauzie otrzymujących raz na dobę 20 mikrogramów etynyloestradiolu wykazało, że leczenie wstępne fulwestrantem w dawce 250 mg znacząco zmniejsza, w porównaniu z placebo, pobudzenie błony śluzowej macicy, co oceniano mierząc ultrasonograficznie grubość endometrium.
Trwające do 16 tygodni leczenie neoadjuwantowe fulwestrantem w dawce 500 mg lub 250 mg nie spowodowało u pacjentek z rakiem piersi znaczącej klinicznie zmiany grubości endometrium, co wskazuje na brak działania agonistycznego. Nie dowiedziono niekorzystnego wpływu na błonę śluzową macicy u badanych pacjentek z rakiem piersi i nie ma danych dotyczących wpływu na jej budowę.
W dwóch krótkotrwałych (trwających 1 i 12 tygodni) badaniach u pacjentek przed menopauzą
z łagodnymi schorzeniami ginekologicznymi nie stwierdzono znaczącej różnicy grubości
endometrium (mierzonej ultrasonograficznie) między grupą otrzymującą fulwestrant i grupą placebo.
Wpływ na kości
Nie ma danych dotyczących odległych skutków działania fulwestrantu na kości. Trwające do
16 tygodni neoadjuwantowe leczenie fulwestrantem w dawce 500 mg lub 250 mg nie spowodowało
u pacjentek z rakiem piersi znaczącej klinicznie zmiany stężenia markerów metabolizmu kości
w surowicy.
Dzieci i młodzież
Fulwestrant nie jest wskazany do stosowania u dzieci. Europejska Agencja Leków uchyliła obowiązek dostarczenia wyników badań fulwestrantu we wszystkich podgrupach pacjentów pediatrycznych we wskazaniu rak piersi (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
W otwartym badaniu II fazy oceniano bezpieczeństwo stosowania, skuteczność oraz parametry farmakokinetyczne fulwestrantu u 30 dziewcząt w wieku od roku do 8 lat z przedwczesnym dojrzewaniem płciowym (ang. progressive precocious puberty) związanym z zespołem McCune’a- Albrighta (MAS). Dzieci otrzymywały co miesiąc domięśniowo fulwestrant w dawce 4 mg/kg mc. To 12-miesięczne badanie pozwoliło na ocenę wielu punktów końcowych istotnych dla leczenia MAS
i wykazało zmniejszenie częstości krwawień z dróg rodnych oraz zmniejszenie wskaźnika
zaawansowania wieku kostnego. Minimalne stężenia fulwestrantu w stanie stacjonarnym u dzieci
w tym badaniu odpowiadały stężeniom notowanym u dorosłych (patrz punkt 5.2). To małe badanie nie dostarczyło żadnych nowych danych dotyczących bezpieczeństwa stosowania, ale wyniki pięcioletniej obserwacji nie są jeszcze dostępne.
Fulwestrant o długotrwałym działaniu podany domięśniowo jest wchłaniany powoli i osiąga maksymalne stężenie w osoczu (Cmax) po około 5 dniach. Fulwestrant podawany w dawce 500 mg osiąga stałe lub prawie stałe stężenia w ciągu pierwszego miesiąca stosowania (średnie wartości odpowiednio: AUC 475 [33,4%] ngdni/ml, Cmax 25,1 [35,1%] ng/ml, Cmin 16,3 [25,9%] ng/ml). Stężenia fulwestrantu w osoczu w stanie stacjonarnym utrzymują się w stosunkowo wąskim zakresie, z około 3-krotną różnicą między stężeniem maksymalnym, a minimalnym. Po podaniu domięśniowym ekspozycja jest w przybliżeniu proporcjonalna do dawki w zakresie dawek od 50 do 500 mg.
Fulwestrant podlega rozległej i szybkiej dystrybucji. Duża pozorna objętość dystrybucji w stanie stacjonarnym (Vdss) o wartości około 3 do 5 l/kg wskazuje, że lek znajduje się głównie w przestrzeni
pozanaczyniowej. Fulwestrant w dużym stopniu (99%) wiąże się z białkami osocza. Głównymi wiążącymi związkami są lipoproteiny o bardzo małej (VLDL), małej (LDL) i dużej gęstości (HDL). Nie badano interakcji wynikających z kompetycyjnego wiązania z białkami. Nie ustalono roli globuliny wiążącej hormony płciowe (SHBP).
Metabolizm fulwestrantu nie został w pełni poznany, ale uczestniczy w nim szereg przemian biologicznych, analogicznych jak w przypadku endogennych steroidów. Zidentyfikowane metabolity (w tym 17-keton, sulfonian, 3-siarczan, 3- i 17-glukuronidy) wykazują mniejszą niż fulwestrant lub porównywalną z nim aktywność antyestrogenową. Badania z wykorzystaniem komórek ludzkiej wątroby i rekombinowanych ludzkich enzymów wątrobowych wskazują, że CYP3A4 jest jedynym izoenzymem cytochromu P450, który uczestniczy w procesie oksydacji fulwestrantu, a w warunkach in vivo wydaje się, że główną rolę odgrywają enzymy nienależące do cytochromu P450. Dane in vitro wskazują, że fulwestrant nie hamuje aktywności izoenzymów układu CYP450.
Fulwestrant jest wydalany głównie w postaci metabolitów, głównie z kałem, a mniej niż w 1%
z moczem. Fulwestrant ma duży klirens (11±1,7 ml/min/kg), co może świadczyć o dużym udziale wątroby w wydalaniu leku. Wartość końcowego okresu półtrwania (t1/2) po podaniu domięśniowym, zależącego od szybkości wchłaniania, oszacowano na 50 dni.
Populacyjna analiza danych z badań III fazy wskazuje na brak różnic w farmakokinetyce fulwestrantu w odniesieniu do wieku (zakres od 33 do 89 lat), masy ciała (40-127 kg) lub rasy.
Zaburzenia czynności nerek
Lekkie do umiarkowanych zaburzenia czynności nerek nie wpływają w sposób istotny klinicznie na farmakokinetykę fulwestrantu.
Zaburzenia czynności wątroby
Farmakokinetykę fulwestrantu oceniono w badaniu klinicznym z zastosowaniem dawki pojedynczej u kobiet z lekkimi do umiarkowanych zaburzeniami czynności wątroby (klasa A i B wg Childa- Pugha). W badaniu stosowano produkt leczniczy o krótszym działaniu, podawany w dużej dawce we wstrzyknięciu domięśniowym. U kobiet z zaburzeniami czynności wątroby wartość AUC była
w przybliżeniu do 2,5-krotnie większa niż u kobiet zdrowych . Oczekuje się, że takie zwiększenie ekspozycji u pacjentek otrzymujących fulwestrant będzie dobrze tolerowane. Nie badano pacjentek z ciężkimi zaburzeniami wątroby (klasa C wg Childa-Pugha).
Dzieci i młodzież
Farmakokinetykę fulwestrantu oceniano w badaniu klinicznym z udziałem 30 dziewcząt
z przedwczesnym dojrzewaniem płciowym związanym z zespołem McCune’a-Albrighta (patrz punkt 5.1). Dzieci w wieku od roku do 8 lat otrzymywały co miesiąc domięśniowo fulwestrant w dawce
4 mg/kg mc. Geometryczna średnia (OS) minimalnego stężenia fulwestrantu w stanie stacjonarnym (Cmin, ss) i AUCss wynosiły odpowiednio 4,2 (0,9) ng/ml i 3680 (1020) ng*godz/ml. Mimo ograniczonej liczby zebranych danych wydaje się, że minimalne stężenia fulwestrantu w stanie stacjonarnym u dzieci odpowiadają wartościom u dorosłych.
Toksyczność fulwestrantu po podaniu jednorazowym jest mała.
Fulwestrant w różnych postaciach był dobrze tolerowany przez gatunki zwierząt uczestniczące
w badaniach z zastosowaniem dawki wielokrotnej. Reakcje miejscowe, w tym zapalenie mięśni
i ziarniniaki w miejscu wkłucia, wynikały z działania substancji pomocniczych leku, ale nasilenie zapalenia mięśni u królików było większe po podaniu fulwestrantu niż po podaniu soli fizjologicznej. Badania toksyczności na szczurach i psach po podaniu wielokrotnych dawek domięśniowych wykazały, że za większość obserwowanych działań fulwestrantu odpowiada jego aktywność antyestrogenowa, zwłaszcza w odniesieniu do żeńskiego układu rozrodczego, ale również innych
narządów wrażliwych na działanie hormonów u obu płci. U niektórych psów otrzymujących fulwestrant przez długi czas (12 miesięcy) obserwowano zapalenie tętnic obejmujące różne tkanki.
W badaniach na psach, którym fulwestrant podawano doustnie i dożylnie, obserwowano wpływ leku na układ sercowo-naczyniowy (niewielkie uniesienie odcinka ST w badaniu EKG po podaniu doustnym i jeden przypadek zahamowania zatokowego po podaniu dożylnym). Działania te wystąpiły przy ekspozycji większej niż u ludzi (Cmax >15 razy) i prawdopodobnie mają ograniczone znaczenie dla bezpieczeństwa pacjentów w praktyce klinicznej.
Fulwestrant nie ma działania genotoksycznego.
Wpływ fulwestrantu podawanego w dawce zbliżonej do dawki leczniczej na reprodukcję i rozwój zarodka i (lub) płodu wynika z jego działania antyestrogenowego. U szczurów obserwowano odwracalne zmniejszenie płodności samic i zmniejszone przeżycie zarodków, dystocję i zwiększoną częstość wad płodów, w tym patologiczne zgięcie śródstopia. U samic królików, którym podawano fulwestrant, występowały poronienia. Obserwowano zwiększoną masę łożyska i obumieranie zarodków po zagnieżdżeniu, a także zwiększoną częstość nieprawidłowości u płodów (w tym wsteczne przesunięcie obręczy miednicy i 27. kręgu przedkrzyżowego).
Dwuletnie badanie działania rakotwórczego u szczurów obu płci, którym podawano fulwestrant domięśniowo, wykazało u samic zwiększoną częstość łagodnych ziarniszczaków jajnika po zastosowaniu dużej dawki (10 mg/szczura/15 dni), a u samców zwiększoną częstość guzów pochodzących z komórek Leydiga w jądrach. Podczas dwuletniego badania działania rakotwórczego u myszy fulwestrant podawany codziennie doustnie w dawce dobowej 150 mg/kg mc. i 500 mg/kg mc. powodował zwiększoną częstość nowotworów sznura płciowego i zrębu jajnika (zarówno łagodnych, jak i złośliwych). Wartość AUC u szczurów po podaniu największej dawki bez
obserwowanego działania (NOEL) była około 1,5-krotnie większa niż oczekiwana ekspozycja u kobiet i 0,8-krotnie większa od ekspozycji u mężczyzn, zaś u myszy około 0,8-krotnie większa od oczekiwanej ekspozycji zarówno u kobiet, jak i u mężczyzn. Indukcja takich nowotworów jest związana ze zmianami stężenia gonadotropin wynikającymi z hormonalnego sprzężenia zwrotnego, spowodowanego przez antyestrogeny u zwierząt czynnych rozrodczo. Dlatego wyników tych badań nie uznaje się za istotne dla stosowania fulwestrantu u kobiet po menopauzie w leczeniu zaawansowanego raka piersi.
Ocena ryzyka dla środowiska
Badania oceny ryzyka dla środowiska wykazały, że fulwestrant może działać niekorzystnie na
środowisko wodne (patrz punkt 6.6).
Etanol (96%) Alkohol benzylowy Benzylu benzoesan Olej rycynowy
Wobec braku badań zgodności, nie mieszać tego produktu leczniczego z innymi lekami.
2 lata
Ten produkt leczniczy nie wymaga żadnych specjalnych warunków przechowywania.
Opakowanie zawiera jedną lub dwie pojedyncze ampułko-strzykawki.
Ampułko-strzykawka z bezbarwnego szkła (typ I) pokrytego silikonem, zamknięta korkiem z gumy
bromobutylowej (pokrytym silikonem), pełniącym funkcję tłoka.
Dodatkowo w opakowaniu z ampułko-strzykawką znajduje się jałowa igła jednorazowego użytku. Nie wszystkie rodzaje i wielkości opakowań muszą znajdować się w obrocie.
stosowania
Wstrzyknięcie należy podawać zgodnie z lokalnymi wytycznymi dotyczącymi wykonywania wstrzyknięć domięśniowych o dużej objętości.
UWAGA: Jeśli produkt Fulvestrant Sandoz jest podawany w górnoboczną okolicę pośladka, należy zachować ostrożność ze względu na bliskość nerwu kulszowego (patrz punkt 4.4).
Ostrzeżenie – nie umieszczać w autoklawie igły z systemem osłaniającym przed jej zastosowaniem.
Podczas stosowania leku i usuwania pozostałości należy unikać kontaktu rąk z igłą.
Strzykawki są dostarczane z igłą z systemem osłaniającym BD SafetyGlide® lub Terumo SurGuard®.
Instrukcja dla igły z systemem osłaniającym BD SafetyGlide®
Dotyczy każdej strzykawki:
ostrego końca. |
|
powietrza. | |
osłaniającego igłę. |
|
| |
UWAGA: Postępuj tak, aby zapewnić bezpieczeństwo sobie i innym. Nasłuchuj kliknięcia i upewnij się wzrokowo, czy końcówka igły jest całkowicie zakryta. | |
Instrukcja dla igły z systemem osłaniającym Terumo SurGuard ®
Dotyczy każdej strzykawki:
| |
| |
w mięsień pośladkowy. | |
o aktywacja palcem wskazującym |
|
o aktywacja kciukiem |
|
o aktywacja o podłoże |
|
Aktywację potwierdza słyszalne i (lub) wyczuwalne kliknięcie, a można ją również stwierdzić wzrokowo. W razie wątpliwości, czy osłona całkowicie zakryła igłę, należy powtórzyć końcowy etap. | |
Usuwanie
Ampułko-strzykawki przeznaczone są wyłącznie do jednorazowego użycia.
Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Sandoz GmbH Biochemiestrasse 10
6250 Kundl, Austria
Pozwolenie nr 22826
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 27.11.2015 r.
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
10.01.2022 r.