Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Metronidavet 500 mg tabletki dla psów i kotów
Metronidavet 500 mg tablets for dogs and cats (BG, FR, HU, IT, RO) Protozoks 500 mg tablets for dogs and cats (AT, CZ, EL, ES, LT, PT) Metroclos 500 mg tablets for dogs and cats (NL, BE)
1 tabletka zawiera:
Substancja czynna:
Metronidazol 500 mg
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Tabletka
Jasnobrązowa z brązowymi plamkami, okrągła i wypukła, aromatyzowana tabletka z linią podziału
w kształcie krzyża po jednej stronie.
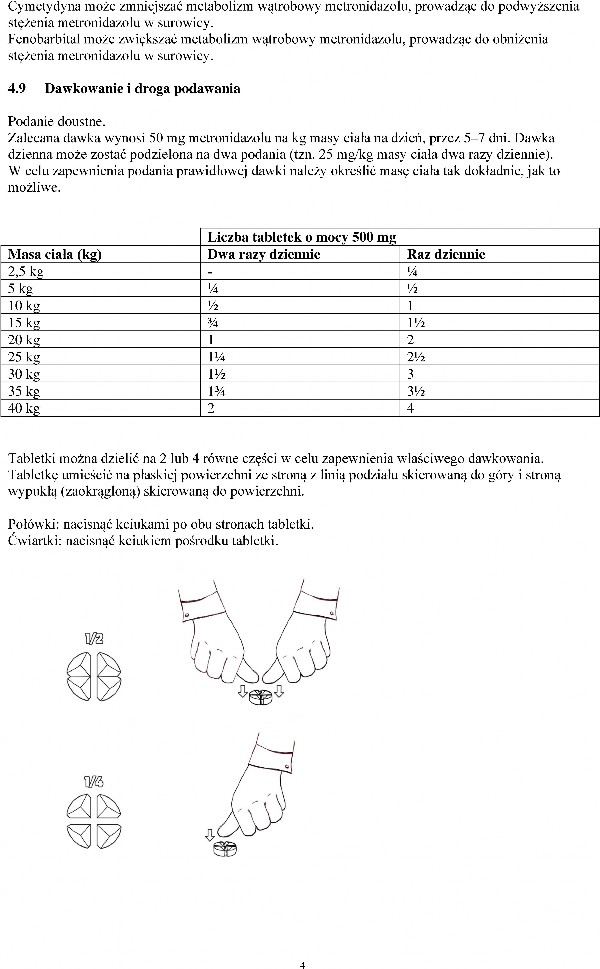
Tabletki mogą być podzielone na 2 lub 4 równe części.
Psy i koty
Leczenie zakażeń przewodu pokarmowego wywołanych przez Giardia spp. i Clostridium spp. (tj. C. perfringens lub C. difficile).
Leczenie zakażeń układu moczowo-płciowego, jamy ustnej, gardła i skóry spowodowanych przez
bakterie bezwzględnie beztlenowe (np. Clostridium spp.), wrażliwe na metronidazol.
Nie stosować w przypadku zaburzeń czynności wątroby.
Nie stosować w przypadku nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
Brak.
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Ze względu na prawdopodobną zmienność (w czasie, geograficzną) występowania oporności bakterii
na metronidazol zalecane jest pobieranie próbek bakteriologicznych i badania lekowrażliwości. Jeśli jest to możliwe, produkt należy stosować wyłącznie w oparciu o badanie lekowrażliwości.
Podczas stosowania produktu leczniczego weterynaryjnego należy uwzględnić oficjalne, krajowe i regionalne wytyczne dotyczące leków przeciwbakteryjnych .
W przypadku przedłużonego leczenia metronidazolem mogą wystąpić objawy neurologiczne. Ponieważ tabletki są aromatyzowane, należy przechowywać je poza zasięgiem zwierząt, aby uniknąć przypadkowego połknięcia.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom:
Metronidazol wykazuje potwierdzone właściwości mutagenne i genotoksyczne u zwierząt laboratoryjnych i u ludzi. Jest potwierdzonym czynnikiem rakotwórczym u zwierząt laboratoryjnych i ma potencjalne działanie rakotwórcze u ludzi, brak jednak wystarczających dowodów na rakotwórczość metronidazolu u ludzi.
Metronidazol może być szkodliwy dla nienarodzonego dziecka. Kobiety w ciąży powinny zachować ostrożność podczas podawania produktu.
Podczas podawania produktu należy nosić nieprzepuszczalne rękawice w celu uniknięcia kontaktu produktu ze skórą oraz przeniesienia go ze skóry do jamy ustnej.
Aby uniknąć przypadkowego połknięcia, szczególnie przez dziecko, niezużyte części tabletki należy włożyć z powrotem do otwartego blistra, a następnie z powrotem do opakowania zewnętrznego
i przechowywać w bezpiecznym miejscu, niewidocznym i niedostępnym dla dzieci.
W przypadku połknięcia należy niezwłocznie zwrócić się o pomoc lekarską oraz pokazać lekarzowi
ulotkę informacyjną lub opakowanie.
Metronidazol może powodować reakcje nadwrażliwości. Osoby o znanej nadwrażliwości na
metronidazol powinny unikać kontaktu z produktem leczniczym weterynaryjnym. Po podaniu tabletek należy dokładnie umyć ręce.
Po podaniu metronidazolu mogą wystąpić następujące działania niepożądane: wymioty, hepatotoksyczność i neutropenia. W bardzo rzadkich przypadkach mogą wystąpić objawy neurologiczne.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
4.7. Stosowanie w ciąży, laktacji lub w okresie nieśności
Ciąża:
W badaniach na zwierzętach laboratoryjnych uzyskano niejednoznaczne wyniki, jeśli chodzi o teratogenne i (lub) embriotoksyczne działanie metronidazolu. Z tego powodu nie zaleca się stosowania produktu w czasie ciąży.
Laktacja:
Metronidazol jest wydalany do mleka i z tego powodu nie zaleca się stosowania w okresie laktacji.
4.8 Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Metronidazol może mieć hamujący wpływ na rozkład w wątrobie innych leków, takich jak fenytoina, cyklosporyna i warfaryna.
Wystąpienie działań niepożądanych jest bardziej prawdopodobne przy dawkach i czasie trwania leczenia przekraczających zalecany schemat dawkowania. W przypadku wystąpienia objawów neurologicznych należy przerwać leczenie, a pacjenta należy leczyć objawowo.
Nie dotyczy.
Grupa farmakoterapeutyczna: leki przeciwpierwotniacze, leki przeciwko chorobom pierwotniaczym, pochodne nitroimidazolu.
Kod ATCvet: QP51AA01
Po przeniknięciu metronidazolu do bakterii, cząsteczka jest redukowana przez wrażliwe bakterie
(beztlenowe). Wytworzone metabolity działają toksycznie wiążąc się z bakteryjnym DNA. W stężeniach równych lub nieznacznie większych niż minimalne stężenie hamujące (MIC) metronidazol działa bakteriobójczo na wrażliwe bakterie.
Metronidazol jest szybko i dobrze wchłaniany po podaniu doustnym. Po godzinie od podania pojedynczej dawki 50 mg stężenie w osoczu osiąga 10 µg/ml. Dostępność biologiczna metronidazolu wynosi prawie 100%, a okres półtrwania w osoczu wynosi około 8–10 godzin. Metronidazol dobrze przenika do tkanek i płynów ustrojowych, takich jak ślina, mleko, wydzieliny pochwy i nasienie.
Metronidazol jest metabolizowany głównie w wątrobie. W ciągu 24 godzin po podaniu doustnym 35–65% podanej dawki (metronidazol i jego metabolity) jest wydalane z moczem.
Celuloza mikrokrystaliczna Karboksymetyloskrobia sodowa (typ A) Hydroksypropyloceluloza
Krzemionka koloidalna uwodniona Magnezu stearynian
Ekstrakt drożdży
Żelaza tlenek, brązowy (E172) (czarny, żółty i czerwony)
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 30 miesięcy.
Okres ważności podzielonych tabletek: 3 dni.
Brak specjalnych środków ostrożności dotyczących przechowywania. Niezużyte części tabletek umieścić z powrotem w blistrze.
Blister PVC – Aluminium – oPA (poliamid orientowany) / lakier termoutwardzalny – Aluminium,
pakowany w pudełko tekturowe.
Wielkości opakowań:
Pudełko tekturowe zawierające 20 tabletek (2 blistry po 10 tabletek). Pudełko tekturowe zawierające 100 tabletek (10 blistrów po 10 tabletek). Pudełko tekturowe zawierające 250 tabletek (25 blistrów po 10 tabletek).
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Przedsiębiorstwo Wielobranżowe Vet-Agro Sp. z o.o. Ul. Gliniana 32
20-616 Lublin, Polska
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB
STOSOWANIA
Nie dotyczy











