Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- Wykaz substancji pomocniczych
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
z nadwrażliwością na substancję czynną, inne niesteroidowe leki przeciwzapalne (NLPZ) lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1,
u których po przyjęciu kwasu acetylosalicylowego lub innych niesteroidowych leków
przeciwzapalnych (NLPZ) występowały kiedykolwiek w przeszłości reakcje nadwrażliwości w postaci skurczu oskrzeli, astmy oskrzelowej, nieżytu błony śluzowej nosa, obrzęku naczynioruchowego lub pokrzywki,
z czynną chorobą wrzodową żołądka i (lub) dwunastnicy lub nawracającym owrzodzeniem lub krwawieniem z przewodu pokarmowego w wywiadzie (dwa lub więcej odrębne epizody potwierdzonego owrzodzenia lub krwawienia),
z krwawieniem z górnego odcinka przewodu pokarmowego lub perforacją w wywiadzie występującymi po zastosowaniu NLPZ,
z ciężką niewydolnością wątroby, ciężką niewydolnością nerek (patrz punkt 4.4),
z ciężką niewydolnością serca (klasa IV wg NYHA),
z krwawieniem z naczyń mózgowych lub z innym czynnym krwawieniem,
ze skazą krwotoczną,
z niewyjaśnionymi zaburzeniami układu krwiotwórczego, takimi jak trombocytopenia,
z ciężkim odwodnieniem (wywołanym wymiotami, biegunką lub niewystarczającym spożyciem płynów),
w ostatnim trymestrze ciąży (patrz punkt 4.6).
Produkt leczniczy jest przeciwwskazany u niemowląt ważących poniżej 5 kg.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
toczniem rumieniowatym układowym oraz mieszaną chorobą tkanki łącznej - zwiększone ryzyko jałowego zapalenia opon mózgowo-rdzeniowych (patrz punkt 4.8),
chorobami przewodu pokarmowego oraz przewlekłymi zapalnymi chorobami jelit, ponieważ stany te mogą ulec nasileniu (wrzodziejące zapalenie jelita grubego, choroba Leśniowskiego- Crohna) (patrz punkt 4.8),
nadciśnieniem tętniczym i (lub) zaburzeniami czynności serca w wywiadzie - należy zachować ostrożność podczas rozpoczynania leczenia; obrzęk, nadciśnienie tętnicze i (lub) niewydolność serca mogą wystąpić w wyniku pogorszenia czynności nerek i (lub) zatrzymania płynów
w organizmie (patrz punkt 4.5),
bezpośrednio po dużym zabiegu chirurgicznym,
zaburzeniami czynności nerek ze względu na pogorszenie czynności nerek (patrz punkty 4.3 i 4.8),
zaburzeniami czynności wątroby (patrz punkty 4.3 i 4.8),
zaburzeniami krzepnięcia krwi (ibuprofen może przedłużyć czas krwawienia).
Przyjmowanie produktu w najmniejszej dawce skutecznej przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko działań niepożądanych (patrz poniżej: wpływ na układ pokarmowy oraz wpływ układ krążenia i krążenie mózgowe).
Pacjenci w podeszłym wieku mają zwiększoną częstość występowania działań niepożądanych po NLPZ, zwłaszcza krwawienia z przewodu pokarmowego i perforacji, które mogą być śmiertelne.
U pacjentów z astmą oskrzelową czynną lub w wywiadzie, lub z chorobami alergicznymi zażycie produktu może spowodować skurcz oskrzeli.
Należy unikać jednoczesnego stosowania ibuprofenu z innymi niesteroidowymi lekami przeciwzapalnymi, w tym inhibitorami COX-2 (patrz punkt 4.5).
Istnieje ryzyko wystąpienia zaburzenia czynności nerek u odwodnionych dzieci i młodzieży. Wpływ na układ pokarmowy
Krwawienie z przewodu pokarmowego, owrzodzenia lub perforacje, które mogą być śmiertelne odnotowywano po wszystkich NLPZ i występowały one na każdym etapie leczenia, poprzedzone lub nie objawami ostrzegawczymi albo poważnymi chorobami przewodu pokarmowego (w tym
wrzodziejącym zapaleniem jelita grubego, chorobą Leśniowskiego-Crohna).
Ryzyko krwawienia z przewodu pokarmowego, owrzodzenia lub perforacji wzrasta wraz ze
zwiększeniem dawki NLPZ, u pacjentów z owrzodzeniem w wywiadzie, zwłaszcza powikłanym krwotokiem lub perforacją (patrz punkt 4.3) oraz u osób w podeszłym wieku. U pacjentów tych leczenie należy rozpoczynać od najmniejszej dostępnej dawki.
Pacjentom, u których występuje działanie toksyczne dotyczące przewodu pokarmowego w wywiadzie, szczególnie osobom w podeszłym wieku, zaleca się zgłaszanie wszelkich niepokojących objawów
brzusznych (zwłaszcza krwawienia z przewodu pokarmowego), w szczególności w początkowych etapach leczenia.
Należy zachować ostrożność u pacjentów, przyjmujących jednocześnie inne leki, które mogą
zwiększać ryzyko zaburzeń żołądkowo-jelitowych lub krwawienia, takie jak kortykosteroidy lub leki przeciwzakrzepowe jak warfaryna, selektywne inhibitory wychwytu zwrotnego serotoniny lub leki antyagregacyjne jak kwas acetylosalicylowy (patrz punkt 4.5).
Ibuprofen należy natychmiast odstawić w przypadku wystąpienia owrzodzeń lub krwawienia z przewodu pokarmowego.
Wpływ na układ krążenia i krążenie mózgowe
Badania kliniczne wskazują, że stosowanie ibuprofenu, zwłaszcza w dużej dawce (2400 mg na dobę), może być związane z niewielkim wzrostem ryzyka wystąpienia tętniczych incydentów zatorowo-
zakrzepowych (na przykład zawału mięśnia sercowego lub udaru). W ujęciu ogólnym badania
epidemiologiczne nie wskazują, że przyjmowanie ibuprofenu w małych dawkach (np. 1200 mg na dobę) jest związane ze zwiększeniem ryzyka wystąpienia tętniczych incydentów zatorowo- zakrzepowych.
W przypadku pacjentów z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca (NYHA II-III), rozpoznaną chorobą niedokrwienną serca, chorobą naczyń obwodowych i (lub) chorobą naczyń mózgowych leczenie ibuprofenem należy stosować po jego starannym rozważeniu, przy czym należy unikać stosowania w dużych dawkach (2400 mg na dobę).
Należy także starannie rozważyć włączenie długotrwałego leczenia pacjentów, u których występują
czynniki ryzyka incydentów sercowo-naczyniowych (nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu), zwłaszcza jeśli wymagane są duże dawki ibuprofenu (2400 mg na dobę).
Wpływ na płodność kobiet Patrz punkt 4.6.
Ciężkie reakcje skórne
Ciężkie reakcje skórne, niektóre z nich śmiertelne, włączając złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka były raportowane w związku ze stosowaniem leków z grupy NLPZ (patrz punkt 4.8). Największe ryzyko wystąpienia tych ciężkich reakcji występuje na początku terapii, w większości przypadków w pierwszym miesiącu stosowania produktu. Zgłaszano przypadki ostrej uogólnionej osutki krostkowej (AGEP) związane ze
stosowaniem produktów zawierających ibuprofen. Należy zaprzestać stosowania ibuprofenu po wystąpieniu pierwszych przedmiotowych i podmiotowych ciężkich reakcji skórnych takich jak: wysypka, zmiany na błonach śluzowych lub jakiekolwiek inne objawy nadwrażliwości.
Maskowanie objawów zakażenia podstawowego
Ibufen dla dzieci FORTE o smaku malinowym może maskować objawy zakażenia, co może
prowadzić do opóźnionego rozpoczęcia stosowania właściwego leczenia, a przez to pogarszać skutki zakażenia. Zjawisko to zaobserwowano w przypadku pozaszpitalnego bakteryjnego zapalenia płuc
i powikłań bakteryjnych ospy wietrznej. Jeśli produkt leczniczy Ibufen dla dzieci FORTE o smaku malinowym stosowany jest z powodu gorączki lub bólu związanych z zakażeniem, zaleca się kontrolowanie przebiegu zakażenia. W warunkach pozaszpitalnych pacjent powinien skonsultować się z lekarzem, jeśli objawy utrzymują się lub nasilają.
Inne uwagi
Jednoczesne, długotrwałe stosowanie różnych leków przeciwbólowych może prowadzić do uszkodzenia nerek z ryzykiem niewydolności nerek (nefropatia postanalgetyczna). Ryzyko to może być zwiększone podczas wysiłku fizycznego, związanego z utratą soli i odwodnieniem i dlatego należy unikać jednoczesnego, długotrwałego stosowania różnych leków przeciwbólowych.
Bardzo rzadko obserwowano ciężkie, ostre reakcje nadwrażliwości (na przykład wstrząs
anafilaktyczny). Po wystąpieniu pierwszych objawów reakcji nadwrażliwości po przyjęciu lub podaniu produktu leczniczego Ibufen dla dzieci FORTE o smaku malinowym, należy przerwać leczenie. Personel medyczny powinien wdrożyć specjalistyczne leczenie w zależności od występujących objawów.
Podczas stosowania ibuprofenu notowano pojedyncze przypadki toksycznej ambliopii, dlatego wszelkie zaburzenia widzenia należy zgłaszać lekarzowi.
Produkt zawiera 2,4 g maltitolu ciekłego (E 965) w każdych 5 ml zawiesiny doustnej. Produkt nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją fruktozy.
Produkt zawiera 5 mg sodu benzoesanu (E 211) w każdych 5 ml zawiesiny doustnej.
Produkt zawiera mniej niż 1 mmol (23 mg) sodu w każdych 5 ml zawiesiny doustnej, to znaczy produkt uznaje się za „wolny od sodu”.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Kwas acetylosalicylowy: jednoczesne stosowanie kwasu acetylosalicylowego i ibuprofenu nie jest zalecane ze względu na możliwość nasilenia działań niepożądanych.
Dane doświadczalne wskazują, że ibuprofen może kompetycyjnie hamować działanie małych dawek kwasu acetylosalicylowego polegające na hamowaniu agregacji płytek krwi, gdy leki te są podawane jednocześnie. Pomimo braku pewności, czy dane te można ekstrapolować do sytuacji klinicznych, nie można wykluczyć, że regularne, długotrwałe stosowanie ibuprofenu może ograniczać działanie kardioprotekcyjne małych dawek kwasu acetylosalicylowego.
Uważa się, że sporadyczne przyjmowanie ibuprofenu nie ma istotnego znaczenia klinicznego (patrz punkt 5.1).
Inne niesteroidowe leki przeciwzapalne, w tym selektywne inhibitory COX-2: należy unikać jednoczesnego stosowania dwóch lub więcej niesteroidowych leków przeciwzapalnych ze względu na zwiększenie występowania działań niepożądanych (patrz punkt 4.4).
Należy zachować ostrożność podczas jednoczesnego stosowania ibuprofenu z poniżej wymienionymi lekami:
Kortykosteroidy: zwiększa się ryzyko owrzodzenia lub krwawienia w obrębie przewodu pokarmowego (patrz punkt 4.4).
Leki przeciwnadciśnieniowe i moczopędne: leki z grupy NLPZ mogą powodować mniejszą skuteczność działania leków zmniejszających ciśnienie tętnicze; leki moczopędne mogą
zwiększać ryzyko działania nefrotoksycznego NLPZ. U niektórych pacjentów z zaburzoną
czynnością nerek (np. pacjenci odwodnieni lub w podeszłym wieku) jednoczesne stosowanie niesteroidowych leków przeciwzapalnych (NLPZ) z inhibitorami ACE, lekami beta- adrenolitycznymi lub antagonistami receptora angiotensyny II może spowodować dalsze pogorszenie czynności nerek, aż do ostrej niewydolności nerek (zwykle odwracalnej). Z tego względu należy zachować ostrożność podczas stosowania leczenia skojarzonego, zwłaszcza u pacjentów w podeszłym wieku. Pacjentów tych należy odpowiednio nawadniać oraz ściśle monitorować czynność nerek na początku leczenia oraz okresowo w trakcie trwania leczenia. Jednoczesne stosowanie ibuprofenu i leków moczopędnych oszczędzających potas może prowadzić do hiperkaliemii.
Leki przeciwzakrzepowe: NLPZ mogą zwiększać działanie leków przeciwzakrzepowych, takich jak warfaryna (patrz punkt 4.4).
Lit i metotreksat: dowiedziono, że niesteroidowe leki przeciwzapalne mogą powodować zwiększenie stężenia w osoczu zarówno litu, jak i metotreksatu.
Zydowudyna: podczas jednoczesnego stosowania NLPZ i zydowudyny zwiększa się ryzyko toksyczności hematologicznej. Istnieją dane wskazujące zwiększone ryzyko krwawienia do stawu oraz powstawania krwiaków u osób HIV-dodatnich z hemofilią leczonych jednocześnie ibuprofenem i zydowudyną.
Glikozydy nasercowe: NLPZ mogą nasilać niewydolność serca, zmniejszać GFR i zwiększać stężenie glikozydów w osoczu.
Fenytoina: ibuprofen może zwiększać stężenie aktywnej farmakologicznie fenytoiny.
Cyklosporyna: zwiększone ryzyko działania nefrotoksycznego.
Takrolimus: ryzyko działania nefrotoksycznego ulega zwiększeniu w przypadku jednoczesnego zastosowania NLPZ.
Antybiotyki chinolonowe: dane uzyskane w badaniach na zwierzętach wskazują, że NLPZ mogą zwiększać ryzyko drgawek związanych ze stosowaniem antybiotyków z grupy
chinolonów. Pacjenci przyjmujący NLPZ i chinolony mogą być narażeni na zwiększone ryzyko wystąpienia drgawek.
Antybiotyki aminoglikozydowe: NLPZ mogą zmniejszać wydalanie aminoglikozydów.
Doustne leki przeciwcukrzycowe: hamowanie metabolizmu pochodnych sulfonylomocznika, wydłużenie okresu półtrwania i zwiększone ryzyko wystąpienia hipoglikemii.
Probenecyd i sulfinpirazon: produkty lecznicze zawierające probenecyd lub sulfinpirazon mogą opóźniać wydalanie ibuprofenu.
Leki przeciwpłytkowe i selektywne inhibitory zwrotnego wychwytu serotoniny (SSRI): zwiększone ryzyko wystąpienia krwawienia z przewodu pokarmowego (patrz punkt 4.4).
Mifepryston: NLPZ nie powinny być używane przez 8-12 dni po zastosowaniu mifeprystonu, ponieważ mogą osłabiać działanie mifeprystonu.
Cholestyramina: w przypadku jednoczesnego podawania ibuprofenu i cholestyraminy, absorpcja ibuprofenu jest opóźniona i zmniejszona (25%). Ibuprofen należy podawać z zachowaniem kilkugodzinnego odstępu.
Worykonazol lub flukonazol: zwiększenie o około 80 do 100% dostępności ibuprofenu S (+) ujawniono w badaniach z flukonazolem i worykonazolem (inhibitory enzymów CYP2C9). Należy rozważyć zmniejszenie dawki ibuprofenu w przypadku jednoczesnego podawania inhibitorów CYP2C9, szczególnie w przypadku podawania dużej dawki ibuprofenu
z worykonazolem lub flukonazolem.
Baklofen: może rozwinąć się działanie toksyczne baklofenu po rozpoczęciu stosowania ibuprofenu.
Rytonawir: rytonawir może zwiększyć stężenie niesteroidowych leków przeciwzapalnych w osoczu.
Wpływ na płodność, ciążę i laktację
toksyczne działanie na płuca i serce (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne);
zaburzenie czynności nerek (patrz powyżej);
pod koniec ciąży u matki i noworodka:
wydłużenie czasu krwawienia, działanie przeciwpłytkowe, które może wystąpić nawet po bardzo małych dawkach;
zahamowanie skurczów macicy skutkujące opóźnieniem lub przedłużeniem porodu.
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
Ibufen dla dzieci FORTE o smaku malinowym, 200 mg/5 ml, zawiesina doustna
5 ml zawiesiny doustnej zawiera 200 mg ibuprofenu (Ibuprofenum).
Substancje pomocnicze o znanym działaniu: maltitol ciekły (E 965), sodu benzoesan (E 211). 5 ml zawiesiny doustnej zawiera 2,4 g maltitolu ciekłego, 5 mg sodu benzoesanu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Zawiesina doustna
Zawiesina koloru białego lub prawie białego, o zapachu i smaku malinowym.
Gorączka różnego pochodzenia (także w przebiegu zakażeń wirusowych).
Bóle różnego pochodzenia o nasileniu słabym do umiarkowanego (także bóle uszu występujące w stanach zapalnych ucha środkowego).
Należy stosować najmniejszą skuteczną dawkę przez najkrótszy okres konieczny do złagodzenia objawów oraz zmniejszenia ryzyka działań niepożądanych (patrz punkt 4.4).
Określając dawkę ibuprofenu należy uwzględnić masę ciała (mc.) i wiek pacjenta. Zwykle stosowana dawka pojedyncza ibuprofenu wynosi od 7 do 10 mg na kg mc., aż do maksymalnej dawki dobowej wynoszącej 30 mg na kg mc.
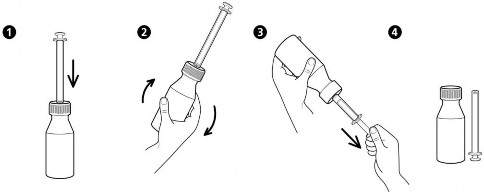
W celu dokładnego dawkowania do opakowania dołączony jest dozownik w formie strzykawki. Przed użyciem butelkę należy wstrząsnąć.
Produkt leczniczy nie zawiera cukru.
Produkt podaje się po posiłkach, z dużą ilością płynów. Należy zachowywać co najmniej 6-godzinną przerwę między kolejnymi dawkami.
Nie należy przekraczać maksymalnej dawki dobowej.
Masa ciała (wiek pacjenta) | Dawka jednorazowa | Częstość podawania na dobę (maksymalna dawka dobowa ibuprofenu) |
5-7,6 kg (3-6 miesięcy) | 1,25 ml (1 × 50 mg) | 3 razy (150 mg) |
7,7-9 kg (6-12 miesięcy) | 1,25 ml (1 × 50 mg) | 3 do 4 razy (150-200 mg) |
10-15 kg (1-3 lat) | 2,5 ml (1 × 100 mg) | 3 razy (300 mg) |
16-20 kg (4-6 lat) | 3,75 ml (1 × 150 mg) | 3 razy (450 mg) |
21-29 kg (7-9 lat) | 5 ml (1 × 200 mg) | 3 razy (600 mg) |
30-40 kg (10-12 lat) | 7,5 ml (1 × 300 mg) | 3 razy (900 mg) |
Powyżej 40 kg (dzieci i młodzież w wieku od 12 lat i dorośli) | 5-10 ml (200-400 mg) | 3 razy (1200 mg) |
W przypadku dzieci w wieku 3-5 miesięcy, należy zasięgnąć porady lekarza, jeśli objawy nasilają się lub jeśli nie ustępują po 24 godzinach.
W przypadku dzieci w wieku powyżej 6 miesięcy, należy zasięgnąć porady lekarza, jeśli podawanie produktu jest konieczne przez więcej niż 3 dni lub jeśli objawy ulegają nasileniu.
Produkt leczniczy przeznaczony do krótkotrwałego stosowania. Rozpoczęte opakowanie należy zużyć w ciągu 6 miesięcy.
Pacjenci w podeszłym wieku: dostosowanie dawki nie jest wymagane. Pacjentów w podeszłym wieku należy monitorować pod względem wystąpienia działań niepożądanych.
Pacjenci z zaburzeniami czynności nerek: u pacjentów z łagodnymi i umiarkowanymi zaburzeniami czynności nerek nie ma potrzeby zmniejszenia dawki.
Pacjenci z zaburzeniami czynności wątroby: u pacjentów z łagodnymi i umiarkowanymi zaburzeniami czynności wątroby nie ma potrzeby zmniejszenia dawki.
Produkt leczniczy jest przeciwwskazany u pacjentów:
Należy zachować ostrożność podczas stosowania produktu leczniczego u pacjentów z:
Ibuprofenu nie należy stosować jednocześnie z poniżej wymienionymi lekami:
Ciąża
Hamowanie syntezy prostaglandyn może mieć niekorzystny wpływ na przebieg ciąży i (lub) na rozwój zarodka lub płodu. Dane z badań epidemiologicznych wskazują na zwiększone ryzyko poronienia i wystąpienia wad wrodzonych serca po podaniu inhibitora syntezy prostaglandyn we wczesnej ciąży. Uważa się, że ryzyko to zwiększa się wraz z dawką i czasem trwania leczenia. Wykazano, że u zwierząt podanie inhibitora syntezy prostaglandyn powoduje zwiększenie częstości przed- i poimplantacyjnej strat ciąż oraz obumarcia zarodka i płodu. Przyjmowanie inhibitorów
syntezy prostaglandyn w trakcie organogenezy płodu zwiększa częstość występowania różnych wad rozwojowych, wliczając w to wady układu krążenia.
Od 20. tygodnia ciąży stosowanie ibuprofenu może powodować małowodzie wskutek zaburzeń
czynności nerek płodu. Może ono wystąpić krótko po rozpoczęciu leczenia i jest zwykle odwracalne po jego przerwaniu. Ponadto zgłaszano przypadki zwężenia przewodu tętniczego po leczeniu
w drugim trymestrze ciąży, z których większość ustąpiła po zaprzestaniu leczenia.
W związku z tym, nie należy podawać ibuprofenu w pierwszym i drugim trymestrze ciąży, chyba że jest to bezwzględnie konieczne. Jeśli ibuprofen jest stosowany u kobiet planujących ciążę oraz
w pierwszym i drugim trymestrze ciąży, należy stosować możliwie jak najmniejszą dawkę, a czas trwania leczenia powinien być jak najkrótszy. Należy rozważyć przedporodowe monitorowanie
w kierunku małowodzia oraz zwężenia przewodu tętniczego po ekspozycji na ibuprofen przez kilka dni od 20. tygodnia ciąży. W przypadku stwierdzenia małowodzia lub zwężenia przewodu tętniczego należy zaprzestać stosowania ibuprofenu.
W trzecim trymestrze ciąży wszystkie inhibitory syntezy prostaglandyn mogą wywołać u płodu:
W związku z tym ibuprofen jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3).
Karmienie piersią
Według ograniczonych badań, ibuprofen przenika do mleka kobiet karmiących piersią w bardzo małych stężeniach i jest mało prawdopodobne, aby wpływał negatywnie na niemowlę karmione piersią.
Płodność
Istnieją dowody na to, że leki hamujące cyklooksygenazę (syntezę prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
W związku z tym, że podczas stosowania produktu leczniczego Ibufen dla dzieci FORTE o smaku malinowym w dużych dawkach mogą wystąpić działania niepożądane dotyczące ośrodkowego układu nerwowego, takie jak zmęczenie i zawroty głowy, w pojedynczych przypadkach dochodzić może do upośledzenia zdolności reakcji i zdolności aktywnego uczestnictwa w ruchu drogowym
i w obsługiwaniu maszyn. Powyższe ostrzeżenie ma szczególne zastosowanie w przypadku zażycia produktu leczniczego z alkoholem.
Podczas krótkotrwałego stosowania ibuprofenu w dawkach dostępnych bez recepty zaobserwowano działania niepożądane wymienione poniżej. Podczas leczenia chorób przewlekłych mogą wystąpić dodatkowe zdarzenia niepożądane.
Działania niepożądane uszeregowano wg częstości występowania stosując następujące określenia: Bardzo często: ≥1/10
Często: ≥1/100 do <1/10
Niezbyt często: ≥1/1 000 do <1/100 Rzadko: ≥1/10 000 do <1/1 000 Bardzo rzadko: <1/10 000
Częstość nieznana (częstość nie może być określona na podstawie dostępnych danych)
Zakażenia i zarażenia pasożytnicze:
Bardzo rzadko: aseptyczne zapalenie opon mózgowo-rdzeniowych.
Zaburzenia krwi i układu chłonnego:
Bardzo rzadko: zaburzenia wskaźników morfologii krwi (anemia, anemia hemolityczna, anemia aplastyczna, leukopenia, trombocytopenia, pancytopenia, agranulocytoza). Pierwszymi objawami są gorączka, ból gardła, powierzchowne owrzodzenia błony śluzowej jamy ustnej, objawy grypopodobne, krańcowe zmęczenie, krwawienie z nosa oraz krwawienia śródskórne.
Zaburzenia układu immunologicznego:
Niezbyt często: reakcje nadwrażliwości z pokrzywką i świądem. Bardzo rzadko:
U pacjentów z istniejącymi chorobami auto-immunologicznymi (takimi jak toczeń rumieniowaty układowy, mieszana choroba tkanki łącznej) podczas leczenia ibuprofenem odnotowano pojedyncze przypadki objawów aseptycznego zapalenia opon mózgowo-rdzeniowych, jak sztywność karku, ból głowy, nudności, wymioty, gorączka, dezorientacja.
Ciężkie reakcje nadwrażliwości. Objawami mogą być: obrzęk twarzy, obrzęk języka i krtani, duszność, tachykardia, hipotensja (anafilaksja, obrzęk naczynioruchowy lub ciężki wstrząs). Zaostrzenie astmy i skurcz oskrzeli.
Zaburzenia psychiczne:
Bardzo rzadko: nerwowość.
W pojedynczych przypadkach opisywano: depresję i reakcje psychotyczne.
Zaburzenia układu nerwowego:
Niezbyt często: bóle głowy.
Rzadko: zawroty głowy, bezsenność, pobudzenie, drażliwość i uczucie zmęczenia.
Zaburzenia oka:
Niezbyt często: zaburzenia widzenia.
Zaburzenia ucha i błędnika:
Rzadko: szumy uszne i zawroty głowy pochodzenia błędnikowego.
Zaburzenia serca:
Bardzo rzadko: obrzęk, nadciśnienie i niewydolność serca związana ze stosowaniem leków z grupy NLPZ.
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia:
Bardzo rzadko: astma, skurcz oskrzeli, duszność i świszczący oddech.
Zaburzenia żołądka i jelit:
Najczęściej obserwowane reakcje niepożądane dotyczą objawów ze strony przewodu pokarmowego. Często: biegunka (ze względu na obecność maltitolu i glicerolu w produkcie leczniczym).
Niezbyt często: niestrawność, ból brzucha i nudności, wzdęcia. Rzadko: wzdęcia z oddawaniem gazów, zaparcia i wymioty.
Bardzo rzadko: choroba wrzodowa żołądka i dwunastnicy, perforacja lub krwawienie z przewodu pokarmowego, smołowate stolce, krwawe wymioty, czasem ze skutkiem śmiertelnym szczególnie u osób w podeszłym wieku; wrzodziejące zapalenie błony śluzowej jamy ustnej, zapalenie błony śluzowej żołądka, owrzodzenie błony śluzowej jamy ustnej.
Zaostrzenie zapalenia okrężnicy i choroby Leśniowskiego-Crohna (patrz punkt 4.4).
Zaburzenia wątroby i dróg żółciowych:
Bardzo rzadko: zaburzenia czynności wątroby, szczególnie podczas długotrwałego stosowania, zapalenie wątroby i żółtaczka.
Zaburzenia skóry i tkanki podskórnej:
Niezbyt często: wysypki skórne różnego typu.
Bardzo rzadko: ciężkie postaci reakcji skórnych takie jak reakcje pęcherzowe, w tym zespół Stevensa- Johnsona, rumień wielopostaciowy i toksyczne martwicze oddzielanie się naskórka.
Częstość nieznana: reakcja polekowa z eozynofilią i objawami ogólnymi (zespół DRESS), ostra uogólniona osutka krostkowa (AGEP), reakcje nadwrażliwości na światło.
Zaburzenia nerek i dróg moczowych:
Bardzo rzadko: ostra niewydolność nerek; martwica brodawek nerkowych, szczególnie po długotrwałym stosowaniu, związana ze zwiększeniem ilości mocznika w surowicy i obrzękiem. Krwiomocz, śródmiąższowe zapalenie nerek, zespół nerczycowy, białkomocz.
Zaburzenia ogólne i stany w miejscu podania:
Bardzo rzadko: obrzęk, obrzęk obwodowy.
Badania diagnostyczne:
Bardzo rzadko: obniżony poziom hematokrytu i hemoglobiny.
Badania kliniczne wskazują, że stosowanie ibuprofenu, zwłaszcza w dużej dawce (2400 mg na dobę), może być związane z niewielkim wzrostem ryzyka wystąpienia tętniczych incydentów zatorowo-
zakrzepowych (na przykład zawału mięśnia sercowego lub udaru mózgu) (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
U dzieci jednokrotne przyjęcie dawki powyżej 400 mg na kg mc. może spowodować objawy przedawkowania.
U dorosłych dokładna dawka mogąca spowodować takie objawy nie jest precyzyjnie określona. Okres półtrwania podczas przedawkowania wynosi 1,5 do 3 godzin.
Objawy
U większości pacjentów przyjmujących klinicznie znaczące dawki NLPZ mogą wystąpić: nudności, wymioty, ból w nadbrzuszu lub rzadziej - biegunka. Mogą także wystąpić: szumy uszne, ból głowy, krwawienie z żołądka lub jelit. Ciężkie zatrucie wpływa na ośrodkowy układ nerwowy i objawia się zawrotami głowy, bólem głowy, depresją oddechową, dusznością, sennością, sporadycznie pobudzeniem i dezorientacją lub śpiączką. Sporadycznie mogą wystąpić napady drgawkowe.
W ciężkim zatruciu może wystąpić kwasica metaboliczna. Mogą wystąpić niedociśnienie tętnicze, hiperkaliemia, a czas protrombinowy/INR może być zwiększony, prawdopodobnie z powodu wpływu na krążące czynniki krzepnięcia. Mogą wystąpić: ostra niewydolność nerek lub uszkodzenie wątroby. U pacjentów z astmą może wystąpić zaostrzenie objawów astmy.
Leczenie
Postępowanie powinno być objawowe i wspomagające i powinno obejmować utrzymanie drożności dróg oddechowych, monitorowanie czynności serca i parametrów życiowych aż do momentu ich ustabilizowania.
Należy rozważyć podanie doustne węgla aktywnego, jeżeli od momentu zażycia przez pacjenta
potencjalnie toksycznych ilości produktu nie upłynęło więcej niż 1 godzina. W przypadku wystąpienia częstych lub przedłużających się napadów drgawkowych, należy podać dożylnie diazepam lub lorazepam. W przypadku pacjentów z astmą należy podać leki rozszerzające oskrzela.
Grupa farmakoterapeutyczna: leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu propionowego, kod ATC: M01AE01
Ibuprofen jest niesteroidowym lekiem przeciwzapalnym (NLPZ), którego skuteczność hamowania syntezy prostaglandyn została potwierdzona w konwencjonalnych modelach zwierzęcych stanu
zapalnego. U ludzi ibuprofen zmniejsza ból związany ze stanem zapalnym, obrzęk oraz gorączkę. Ponadto, ibuprofen w odwracalny sposób hamuje agregację płytek krwi.
Potwierdzono kliniczną skuteczność ibuprofenu w leczeniu bólu o nasileniu słabym do umiarkowanego, takiego jak ból zębów, ból głowy oraz leczeniu objawowym gorączki.
Doustna przeciwbólowa dawka dla dzieci wynosi od 7 do 10 mg na kg mc. na dawkę, do maksymalnej dawki dobowej 30 mg na kg mc. Ibufen dla dzieci FORTE o smaku malinowym zawiera ibuprofen, który wykazuje początek działania w ciągu 15 minut od podania i obniża gorączkę u dzieci do
8 godzin.
Dane doświadczalne wskazują, że ibuprofen może kompetycyjnie hamować działanie małych dawek kwasu acetylosalicylowego polegające na hamowaniu agregacji płytek krwi, gdy leki te są podawane jednocześnie. Niektóre badania farmakodynamiczne wykazały, że po podaniu pojedynczej dawki ibuprofenu (400 mg) w ciągu 8 godzin przed podaniem dawki kwasu acetylosalicylowego
o natychmiastowym uwalnianiu (81 mg), lub 30 minut po jej podaniu, występuje osłabienie wpływu kwasu acetylosalicylowego na powstawanie tromboksanu lub agregację płytek. Pomimo braku pewności, czy dane te można ekstrapolować do sytuacji klinicznych, nie można wykluczyć, że
regularne, długotrwałe stosowanie ibuprofenu może ograniczać działanie kardioprotekcyjne małych dawek kwasu acetylosalicylowego. Uważa się, że sporadyczne przyjmowanie ibuprofenu nie ma istotnego znaczenia klinicznego (patrz punkt 4.5).
Nie prowadzono odrębnych badań farmakokinetyki u dzieci. Dane literaturowe potwierdzają, że wchłanianie, metabolizm i wydalanie ibuprofenu u dzieci przebiega w podobny sposób, jak
u dorosłych.
Ibuprofen po podaniu doustnym jest częściowo wchłaniany w żołądku, a następnie całkowicie w jelicie cienkim.
Po zmetabolizowaniu w wątrobie (hydroksylacji, karboksylacji, koniugacji) farmakologicznie nieaktywne metabolity są całkowicie wydalone, głównie przez nerki (90%) oraz z żółcią. Okres półtrwania u osób zdrowych, jak również u pacjentów z zaburzeniami czynności wątroby lub
zaburzeniami czynności nerek wynosi od 1,8 do 3,5 godziny. Wiązanie z białkami wynosi około 99%. Według ograniczonych badań, ibuprofen przenika do mleka kobiecego w bardzo małym stężeniach.
Zaburzenia czynności nerek
Ze względu na to, że ibuprofen i jego metabolity są wydalane głównie przez nerki, u pacjentów z różnym stopniem niewydolności nerek mogą wystąpić zmiany dotyczące właściwości farmakokinetycznych leku.
Zmniejszenie stopnia wiązania z białkami, zwiększenie stężenia całkowitego ibuprofenu
i niezwiązanego enancjomeru (S)-ibuprofenu w osoczu, podwyższone wartości AUC dla enancjomeru S oraz zwiększenie stosunku AUC enancjomerów S/R obserwowano u pacjentów z niewydolnością nerek, w porównaniu do grupy kontrolnej zdrowych ochotników.
W schyłkowym stadium choroby nerek, u pacjentów dializowanych, średnie wartości wolnych frakcji ibuprofenu wynosiły około 3% w porównaniu z około 1% u zdrowych ochotników. Ciężkie zaburzenia czynności nerek mogą prowadzić do nagromadzenia metabolitów ibuprofenu. Znaczenie tego faktu jest nieznane. Metabolity mogą być wyeliminowane za pomocą hemodializy (patrz punkt 4.3).
Zaburzenia czynności wątroby
Alkoholowa choroba wątroby z łagodną lub umiarkowaną niewydolnością wątroby nie powodują
znaczącej zmiany parametrów farmakokinetycznych. Choroba wątroby może wpływać na metabolizm ibuprofenu. U pacjentów z marskością wątroby oraz z umiarkowaną niewydolnością wątroby (stopień 6-10 według skali Child-Pugh) obserwowano średnio 2-krotne wydłużenie okresu półtrwania,
z wartością stosunku AUC enancjomerów S/R znacznie niższą w porównaniu z grupą kontrolną zdrowych ochotników, co sugeruje zaburzenia metaboliczne inwersji ibuprofenu enancjomer (R) do aktywnego (S) kwasu (patrz także punkt 4.3).
W doświadczeniach przeprowadzonych na zwierzętach, toksyczne działanie ibuprofenu zostało
zaobserwowane w obrębie przewodu pokarmowego (zmiany chorobowe i owrzodzenia). Ibuprofen nie wykazywał klinicznie istotnych działań mutagennych w badaniach in vitro i in vivo. W badaniach na myszach i szczurach nie stwierdzono także własności rakotwórczych. Ibuprofen hamował owulację
u królików. Prowadził do zaburzeń implantacji u różnych gatunków zwierząt (króliki, szczury
i myszy). Dane doświadczalne wykazały, że ibuprofen przenika barierę łożyska. W następstwie podawania dawek toksycznych dla matek zwierząt zaobserwowano wzrost częstości występowania wad rozwojowych (np. wad przegrody międzykomórkowej).
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Hypromeloza Guma ksantan Glicerol (E 422)
Sodu benzoesan (E 211) Maltitol ciekły (E 965) Sodu cytrynian
Kwas cytrynowy jednowodny Sacharyna sodowa (E 954) Sodu chlorek
Aromat malinowy Woda oczyszczona
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Nie dotyczy.
2 lata
Po pierwszym otwarciu: 6 miesięcy.
Nie przechowywać w temperaturze powyżej 25ºC.
Butelka z PET o pojemności 40 ml lub 100 ml z łącznikiem z LDPE, zamknięta zakrętką z HDPE zabezpieczającą przed dostępem dzieci i pierścieniem gwarancyjnym, umieszczona wraz z doustną strzykawką o pojemności 5 ml (cylinder z LDPE, tłok z PS) w tekturowym pudełku.
Instrukcja użytkowania dozownika w formie strzykawki
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Zakłady Farmaceutyczne POLPHARMA S.A. ul. Pelplińska 19, 83-200 Starogard Gdański
Pozwolenie nr 21885
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 28.05.2014 r. Data przedłużenia pozwolenia: 11.09.2019 r.











