Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
bóle głowy, gardła i mięśni (np. w przebiegu zakażeń wirusowych),
bóle zębów, bóle po zabiegach stomatologicznych, bóle na skutek ząbkowania,
bóle stawów i kości, na skutek urazów narządu ruchu (np. skręcenia),
bóle na skutek urazów tkanek miękkich,
bóle pooperacyjne,
bóle uszu występujące w stanach zapalnych ucha środkowego.
Dawkowanie i sposób podawania
przed pierwszym użyciem strzykawki należy ją bezwzględnie umyć w ciepłej (nie wrzącej) wodzie z dodatkiem środka myjącego,
po odkręceniu zakrętki nałożyć strzykawkę na korek umieszczony w szyjce butelki,
aby napełnić strzykawkę, butelkę należy energicznie wstrząsnąć, odwrócić do góry dnem, a następnie ostrożnie przesuwać tłok strzykawki do dołu, wciągając zawiesinę w pożądanej ilości określonej na podziałce,
w celu dokładnego odmierzenia dawki kołnierz korpusu strzykawki powinien zostać ustawiony na linii podziałki znajdującej się na tłoku,
butelkę odwrócić do pozycji początkowej i ostrożnie wyjąć strzykawkę z korka (jak przedstawiono na rysunku),
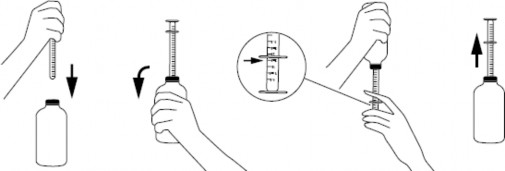
końcówkę strzykawki należy umieścić w ustach dziecka, a następnie wolno wciskając tłok, ostrożnie opróżnić zawartość strzykawki,
po zastosowaniu butelkę zamknąć, a strzykawkę doustną umyć w ciepłej (nie wrzącej) wodzie z dodatkiem środka myjącego i wysuszyć.
Produkt przeznaczony jest do stosowania doraźnego, dlatego jeżeli objawy utrzymują się lub nasilają albo jeśli wystąpią nowe objawy, należy skonsultować się z lekarzem.
U pacjentów z wrażliwym żołądkiem zalecane jest stosowanie produktu leczniczego IBUM FORTE podczas posiłków.
Produkt leczniczy nie zawiera cukru i etanolu. Może być stosowany przez osoby chore na cukrzycę (5 ml zawiesiny zawiera 1,119 g maltitolu ciekłego, co odpowiada około 0,07 wymiennika węglowodanowego).
Szczególne grupy pacjentów
Pacjenci z zaburzeniami czynności nerek
U pacjentów z łagodnym lub umiarkowanym zaburzeniem czynności nerek nie jest konieczne zmniejszenie dawki (pacjenci z ciężką niewydolnością nerek, patrz punkt 4.3).
Pacjenci z zaburzeniami czynności wątroby
U pacjentów z łagodnym lub umiarkowanym zaburzeniem czynności wątroby nie jest konieczne zmniejszenie dawki (pacjenci z ciężką niewydolnością wątroby, patrz punkt 4.3).
Przeciwwskazania
Nadwrażliwość na ibuprofen lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Nie stosować u osób, u których w trakcie leczenia kwasem acetylosalicylowym lub innymi niesteroidowymi lekami przeciwzapalnymi (NLPZ) występowały w przeszłości jakiekolwiek objawy alergii w postaci zapalenia błony śluzowej nosa, pokrzywki, skurczu oskrzeli lub astmy.
Choroba wrzodowa żołądka i (lub) dwunastnicy czynna lub nawracająca w wywiadzie, perforacja lub krwawienie, również występujące po zastosowaniu NLPZ (patrz punkt 4.4).
Ciężka niewydolność wątroby, ciężka niewydolność nerek.
Ciężka niewydolność serca (klasa IV wg NYHA).
III trymestr ciąży (patrz punkt 4.6).
Naczyniowo-mózgowe lub inne czynne krwawienie.
Zaburzenia krzepnięcia (ibuprofen może wydłużać czas krwawienia), skaza krwotoczna.
Zaburzenia wytwarzania krwi o nieustalonym pochodzeniu, takie jak małopłytkowość.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
toczeń rumieniowaty układowy oraz mieszana choroba tkanki łącznej – może wystąpić zwiększone ryzyko rozwoju jałowego zapalenia opon mózgowych (patrz punkt 4.8);
choroby przewodu pokarmowego oraz przewlekłe zapalne choroby jelit (wrzodziejące zapalenie jelita grubego, choroba Leśniowskiego-Crohna) – może wystąpić zaostrzenie choroby (patrz punkt 4.8);
nadciśnienie tętnicze i (lub) zaburzenie czynności serca w wywiadzie – opisywano zatrzymanie płynów i obrzęki związane z przyjmowaniem NLPZ (patrz punkt 4.3 i punkt 4.8);
zaburzenia czynności nerek – istnieje ryzyko dalszego pogorszenia czynności nerek (patrz punkt
4.3 i punkt 4.8);
zaburzenia czynności wątroby (patrz punkt 4.3 i punkt 4.8);
bezpośrednio po dużym zabiegu chirurgicznym.
Należy unikać jednoczesnego stosowania ibuprofenu z innymi niesteroidowymi lekami przeciwzapalnymi, w tym inhibitorami COX-2 (zwiększone ryzyko wystąpienia działań niepożądanych – patrz punkt 4.5).
U pacjentów z astmą oskrzelową lub z chorobami alergicznymi w wywiadzie może wystąpić skurcz oskrzeli.
Przyjmowanie leku w najmniejszej skutecznej dawce przez najkrótszy okres konieczny do łagodzenia objawów zmniejsza ryzyko wystąpienia działań niepożądanych (patrz wpływ na przewód pokarmowy i układ krążenia).
Pacjenci w podeszłym wieku
U pacjentów w podeszłym wieku istnieje zwiększone ryzyko wystąpienia działań niepożądanych w związku ze stosowaniem leków z grupy NLPZ, szczególnie krwawień i perforacji przewodu pokarmowego, które mogą prowadzić do zgonu.
Wpływ na przewód pokarmowy
Istnieje ryzyko wystąpienia krwotoku z przewodu pokarmowego, owrzodzenia lub perforacji, które mogą mieć skutek śmiertelny i które niekoniecznie muszą być poprzedzone objawami ostrzegawczymi lub mogą wystąpić u pacjentów, u których takie objawy ostrzegawcze występowały. W przypadku wystąpienia krwawienia lub owrzodzenia przewodu pokarmowego należy przerwać stosowanie ibuprofenu. Należy poinformować pacjentów z chorobami przewodu pokarmowego w wywiadzie, szczególnie pacjentów w podeszłym wieku, o konieczności zgłaszania lekarzowi wszelkich nietypowych objawów dotyczących przewodu pokarmowego (szczególnie krwawienia), zwłaszcza w początkowym okresie leczenia. Pacjenci ci powinni stosować jak najmniejszą dawkę produktu leczniczego. U tych pacjentów oraz u pacjentów wymagających skojarzonego stosowania małych dawek kwasu acetylosalicylowego lub innych leków zwiększających ryzyko wystąpienia reakcji układu pokarmowego należy rozważyć leczenie skojarzone z lekami osłonowymi (np. mizoprostolem lub inhibitorami pompy protonowej) (patrz poniżej i punkt 4.5).
Należy zachować ostrożność stosując ibuprofen u pacjentów przyjmujących jednocześnie inne leki, które mogą zwiększyć ryzyko wystąpienia zaburzeń żołądka i jelit lub krwawienia, takie jak kortykosteroidy lub leki przeciwzakrzepowe, takie jak warfaryna (acenokumarol) lub leki antyagregacyjne, takie jak kwas acetylosalicylowy.
Jeżeli wystąpi krwawienie z przewodu pokarmowego lub owrzodzenie u pacjentów otrzymujących produkt, leczenie należy przerwać.
Należy zachować szczególną ostrożność przed zastosowaniem produktu leczniczego u pacjentów z nadciśnieniem tętniczym i (lub) niewydolnością serca z zatrzymaniem płynów, nadciśnieniem i obrzękiem, które są związane ze stosowaniem NLPZ w wywiadzie. W takich przypadkach pacjent powinien skonsultować się z lekarzem lub farmaceutą.
Wpływ na układ krążenia i naczynia mózgowe
Badania kliniczne wskazują, że stosowanie ibuprofenu, zwłaszcza w dużej dawce (2400 mg/dobę), może być związane z niewielkim wzrostem ryzyka wystąpienia tętniczych incydentów zatorowo - zakrzepowych (na przykład zawału mięśnia sercowego lub udaru). W ujęciu ogólnym badania epidemiologiczne nie wskazują, że przyjmowanie ibuprofenu w małych dawkach (np. 1200 mg na dobę) jest związane ze zwiększeniem ryzyka wystąpienia tętniczych incydentów zatorowo- zakrzepowych.
W przypadku pacjentów z niekontrolowanym nadciśnieniem tętniczym, zastoinową niewydolnością serca (NYHA II-III), rozpoznaną chorobą niedokrwienną serca, chorobą naczyń obwodowych i (lub) chorobą naczyń mózgowych leczenie ibuprofenem należy stosować po jego starannym rozważeniu, przy czym należy unikać stosowania w dużych dawkach (2400 mg/dobę).
Należy także starannie rozważyć włączenie długotrwałego leczenia pacjentów, u których występują czynniki ryzyka incydentów sercowo-naczyniowych (nadciśnienie tętnicze, hiperlipidemia, cukrzyca, palenie tytoniu), zwłaszcza jeśli wymagane są duże dawki ibuprofenu (2400 mg/dobę).
Wpływ na nerki
Jednoczesne, długotrwałe stosowanie leków przeciwbólowych może prowadzić do uszkodzenia nerek z ryzykiem niewydolności nerek (nefropatia postanalgetyczna). To ryzyko może zostać zwiększone pod wpływem wysiłku fizycznego związanego z utratą soli i odwodnieniem, dlatego należy go unikać. Istnieje ryzyko zaburzenia czynności nerek u odwodnionych dzieci i młodzieży.
Ciężkie reakcje skórne
Ciężkie reakcje skórne, niektóre z nich śmiertelne, włączając złuszczające zapalenie skóry, zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, były bardzo rzadko raportowane w związku ze stosowaniem leków z grupy NLPZ. Największe ryzyko wystąpienia tych ciężkich reakcji istnieje na początku terapii, w większości przypadków w pierwszym miesiącu stosowania.
Zgłaszano przypadki ostrej uogólnionej osutki krostkowej (AGEP) związane ze stosowaniem produktów zawierających ibuprofen. Należy zaprzestać stosowania produktu po wystąpieniu
pierwszych objawów wysypki skórnej, uszkodzenia błony śluzowej lub innych objawów nadwrażliwości.
W wyjątkowych przypadkach ospa wietrzna może być źródłem ciężkich powikłanych zakażeń skóry i tkanek miękkich. W chwili obecnej nie można wykluczyć wpływu leków z grupy NLPZ na pogorszenie się tych zakażeń. Tak więc zaleca się, aby unikać stosowania ibuprofenu w przypadku ospy wietrznej.
Ciężkie, ostre reakcje nadwrażliwości (np. wstrząs anafilaktyczny) są obserwowane bardzo rzadko. Po wystąpieniu pierwszych objawów reakcji nadwrażliwości po przyjęciu lub podaniu produktu IBUM FORTE leczenie musi być przerwane. Personel medyczny powinien wdrożyć niezbędne postępowanie dostosowane do objawów.
Ibuprofen może czasowo hamować czynność płytek krwi (agregacja trombocytów). W związku z tym należy uważnie monitorować stan pacjentów z zaburzeniami krzepnięcia.
Wyniki badań doświadczalnych wskazują, że stosowanie ibuprofenu w skojarzeniu z kwasem acetylosalicylowym (ASA) wpływa na osłabienie działania ASA, polegającego na hamowaniu agregacji trombocytów. Ta interakcja może ograniczyć pożądane działanie ochronne ASA na układ krążenia. Dlatego ibuprofen powinien być stosowany ze szczególną ostrożnością u pacjentów otrzymujących ASA w celu hamowania agregacji trombocytów (patrz punkt 4.5).
Podczas długotrwałego podawania ibuprofenu, wskazana jest regularna kontrola parametrów wątroby, czynności nerek, a także morfologii krwi.
Podczas długotrwałego stosowania leków przeciwbólowych może wystąpić ból głowy, którego nie należy leczyć podaniem zwiększonych dawek produktu.
Maskowanie objawów zakażenia podstawowego
IBUM FORTE może maskować objawy zakażenia, co może prowadzić do opóźnionego rozpoczęcia stosowania właściwego leczenia, a przez to pogarszać skutki zakażenia. Zjawisko to zaobserwowano w przypadku pozaszpitalnego bakteryjnego zapalenia płuc i powikłań bakteryjnych ospy wietrznej. Jeśli produkt leczniczy IBUM FORTE stosowany jest z powodu gorączki lub bólu związanych z zakażeniem, zaleca się kontrolowanie przebiegu zakażenia. W warunkach pozaszpitalnych pacjent powinien skonsultować się z lekarzem, jeśli objawy utrzymują się lub nasilają.
Należy poinformować pacjenta, aby skontaktował się z lekarzem lub farmaceutą w przypadku wystąpienia nowych lub nasilenia występujących objawów.
Istnieją dowody na to, że substancje hamujące cyklooksygenazę (enzym biorący udział w syntezie prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
Specjalne ostrzeżenia dotyczące substancji pomocniczych
Maltitol ciekły (E 965)
Produkt leczniczy zawiera 1,119 g maltitolu ciekłego w każdych 5 ml zawiesiny.
Produkt leczniczy nie powinien być stosowany u pacjentów z rzadko występującą dziedziczną nietolerancją fruktozy.
Sodu benzoesan (E 211)
Produkt leczniczy zawiera 3,357 mg sodu benzoesanu w każdych 5 ml zawiesiny.
Glikol propylenowy (E 1520)
Produkt leczniczy zawiera 12,78 mg glikolu propylenowego w każdych 5 ml zawiesiny.
Sód
Produkt leczniczy zawiera 18,40 mg sodu na 5 ml zawiesiny, co odpowiada 0,92% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
kwas acetylosalicylowy lub inne leki z grupy NLPZ i glikokortykosteroidy. Mogą zwiększać ryzyko wystąpienia działań niepożądanych dotyczących przewodu pokarmowego.
Jednoczesne stosowanie kwasu acetylosalicylowego i ibuprofenu nie jest zalecane ze względu na możliwość nasilenia działań niepożądanych.
Dane doświadczalne wskazują, że ibuprofen może kompetycyjnie hamować działanie małych dawek kwasu acetylosalicylowego polegające na hamowaniu agregacji płytek krwi, gdy leki te są podawane jednocześnie. Pomimo braku pewności, czy dane te można ekstrapolować do sytuacji klinicznych, nie można wykluczyć, że regularne, długotrwałe stosowanie ibuprofenu może ograniczać działanie kardioprotekcyjne małych dawek kwasu acetylosalicylowego. Uważa się, że sporadyczne przyjmowanie ibuprofenu nie ma istotnego znaczenia klinicznego (patrz punt 5.1).
Środki ostrożności wymagane podczas skojarzonego stosowania z następującymi produktami leczniczymi:
leki moczopędne, inhibitory ACE, leki blokujące receptory beta i antagoniści receptora angiotensyny II:
Leki z grupy NLPZ mogą osłabiać działanie leków moczopędnych i innych leków przeciwnadciśnieniowych. U niektórych pacjentów z osłabioną czynnością nerek (np. pacjentów odwodnionych lub pacjentów w podeszłym wieku z osłabioną czynnością nerek) skojarzone stosowanie inhibitora ACE, leku beta-adrenolitycznego lub antagonistów receptora angiotensyny II
i leków hamujących cyklooksygenazę może spowodować dalsze pogorszenie czynności nerek, w tym możliwą ostrą niewydolność nerek, która zazwyczaj jest odwracalna. Dlatego, to skojarzenie należy stosować z ostrożnością, szczególnie u osób w podeszłym wieku. Pacjenci powinni być odpowiednio nawodnieni i należy rozważyć monitorowanie czynności nerek po rozpoczęciu leczenia skojarzonego, a następnie okresowo.
Jednoczesne podawanie produktu leczniczego IBUM FORTE i leków moczopędnych oszczędzających potas może prowadzić do hiperkaliemii.
glikozydy naparstnicy, fenytoina, lit:
Jednoczesne stosowanie produktu leczniczego IBUM FORTE z glikozydami naparstnicy, fenytoiną lub produktami zawierającymi lit może zwiększać stężenie tych produktów leczniczych w surowicy.
Kontrola stężenia litu w surowicy, stężenia glikozydów naparstnicy w surowicy i fenytoiny w surowicy nie jest z reguły konieczna w przypadku stosowania produktu zgodnie z zaleceniami (maksymalnie przez 3 do 4 dni).
metotreksat: Istnieje dowód na możliwe zwiększenie stężenia metotreksatu w osoczu. Leki z grupy NLPZ hamują wydzielanie kanalikowe metotreksatu co może prowadzić do zmniejszenia klirensu metotreksatu. W leczeniu dużymi dawkami metotreksatu, należy unikać stosowania ibuprofenu (leku z grupy NLPZ). Należy uwzględnić ryzyko wystąpienia interakcji między lekami z grupy NLPZ a metotreksatem w trakcie leczenia małą dawką metotreksatu, szczególnie u pacjentów z niewydolnością nerek. W trakcie leczenia skojarzonego metotreksatem i lekami z grupy NLPZ należy monitorować czynność nerek. Zaleca się zachowanie ostrożności, jeśli leki z grupy NLPZ i metotreksat są podawane w ciągu 24 godzin,
ponieważ może nastąpić zwiększenie stężenia metotreksatu w osoczu co może skutkować zwiększeniem działania toksycznego.
takrolimus: Jeśli oba produkty lecznicze podawane są w skojarzeniu istnieje zwiększone ryzyko wystąpienia działania toksycznego na nerki.
cyklosporyna: Istnieją ograniczone dane dotyczące możliwych interakcji prowadzących do zwiększonego ryzyka wystąpienia działania toksycznego na nerki.
kortykosteroidy: Zwiększone ryzyko owrzodzenia lub krwawienia z przewodu pokarmowego (patrz punkt 4.4).
leki przeciwzakrzepowe: Leki z grupy NLPZ mogą zwiększać działanie leków przeciwzakrzepowych, takich jak warfaryna (patrz punkt 4.4).
leki przeciwpłytkowe i selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI): Zwiększone ryzyko krwawienia z przewodu pokarmowego (patrz punkt 4.4).
sulfonylomocznik: Badania kliniczne wykazały interakcje między lekami z grupy NLPZ i lekami przeciwcukrzycowymi (pochodne sulfonylomocznika). Mimo, że interakcje pomiędzy ibuprofenem i pochodnymi sulfonylomocznika nie zostały opisane do tej pory, zaleca się kontrolę stężenia glukozy we krwi jako środek ostrożności w trakcie stosowania skojarzonego.
zydowudyna: Istnieją dane dotyczące zwiększonego ryzyka wylewów krwi do stawu i krwiaków u chorych z HIV (+) z hemofilią leczonych w skojarzeniu zydowudyną i ibuprofenem.
probenecyd i sulfinpirazon: Produkty lecznicze, które zawierają probenecyd lub sulfinpirazon mogą opóźnić wydalanie ibuprofenu.
baclofen: Działanie toksyczne baclofenu może wystąpić po rozpoczęciu stosowania ibuprofenu.
rytonawir: Rytonawir może zwiększać stężenie leków z grupy NLPZ w osoczu.
aminoglikozydy: leki z grupy NLPZ mogą zmniejszyć wydalanie aminoglikozydów.
antybiotyki z grupy chinolonów: Dane uzyskane z badań na zwierzętach wskazują, że leki z grupy NLPZ mogą zwiększać ryzyko wystąpienia drgawek związanych z antybiotykami z grupy chinolonów. U pacjentów przyjmujący leki z grupy NLPZ oraz antybiotyki z grupy chinolonów istnieje zwiększone ryzyko drgawek.
w badaniu z worykonazolem i flukonazolem (inhibitory enzymu CYP2C9) wykazano zwiększony o około 80 do 100% wypływ S (+) ibuprofenu. Należy rozważyć zmniejszenie dawki ibuprofenu gdy podawane są silne inhibitory CYP2C9 w skojarzeniu, szczególnie gdy podawana jest duża dawka ibuprofenu z worykonazolem lub flukonazolem.
kaptopryl: Badania doświadczalne wskazują, że ibuprofen hamuje działanie kaptoprylu na wydalanie sodu.
cholestyramina: Podczas skojarzonego stosowania ibuprofenu i cholestyraminy wchłanianie ibuprofenu jest opóźnione i zmniejszone (25%). Produkty lecznicze należy podawać w kilkugodzinnych przerwach.
mifepryston: Nie należy stosować NLPZ w okresie 8 - 12 dni po podaniu mifeprystonu, ponieważ mogą one osłabiać działanie mifeprystonu.
inne NLPZ, w tym selektywne inhibitory cyklooksygenazy-2: należy unikać jednoczesnego stosowania ibuprofenu z innymi niesteroidowymi lekami przeciwzapalnymi, w tym inhibitorami COX-2 (zwiększone ryzyko wystąpienia działań niepożądanych – patrz punkt 4.4).
Wpływ na płodność, ciążę i laktację
działania toksycznego na serce i płuca (przedwczesne zwężenie/zamknięcie przewodu tętniczego i nadciśnienie płucne),
zaburzenia czynności nerek (patrz powyżej);
a matkę i płód w końcowym okresie ciąży na wystąpienie:
wydłużonego czasu krwawienia, działania przeciwpłytkowego, które może wystąpić już po zastosowaniu bardzo małych dawek,
opóźnienia lub wydłużenia akcji porodowej spowodowane hamowaniem skurczów macicy.
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
IBUM FORTE, 200 mg/5 ml, zawiesina doustna
5 ml zawiesiny doustnej zawiera 200 mg ibuprofenu (Ibuprofenum).
Substancje pomocnicze o znanym działaniu: 5 ml zawiesiny doustnej zawiera 1,119 g maltitolu ciekłego (E 965), 3,357 mg sodu benzoesanu (E 211), 12,78 mg glikolu propylenowego (E 1520) i
18,40 mg sodu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Zawiesina doustna.
Zawiesina doustna barwy białej o truskawkowym zapachu.
Gorączka różnego pochodzenia, między innymi w przebiegu grypy, przeziębienia lub innych chorób zakaźnych, a także w przebiegu odczynu poszczepiennego.
Bóle różnego pochodzenia o nasileniu słabym do umiarkowanego, takie jak:
Dawkowanie
Dawka dobowa produktu IBUM FORTE jest ściśle uzależniona od masy ciała i wynosi 20-30 mg/kg mc., w dawkach podzielonych, zgodnie z poniższą tabelą.
Wiek dziecka (masa ciała dziecka) | Dawka jednorazowa | Maksymalna dawka dobowa |
3-6 miesięcy (5-7,6 kg) | 1,25 ml (50 mg) | 3 razy po 1,25 ml = 150 mg |
6-12 miesięcy (7,7-9 kg) | 1,25 ml (50 mg) | 3-4 razy po 1,25 ml = 150-200 mg |
1-3 lat (10-15 kg) | 2,5 ml (100 mg) | 3 razy po 2,5 ml = 300 mg |
4-6 lat (16-20 kg) | 3,75 ml (150 mg) | 3 razy po 3,75 ml = 450 mg |
7-9 lat (21-29 kg) | 5 ml (200 mg) | 3 razy po 5 ml = 600 mg |
10-12 lat (30-40 kg) | 7,5 ml (300 mg) | 3 razy po 7,5 ml = 900 mg |
powyżej 40 kg | 7,5-10 ml (300-400 mg) | 3-4 razy po 7,5 ml = 900-1200 mg |
U niemowląt poniżej 6. m-ca życia można podawać produkt tylko po konsultacji z lekarzem. Produkt leczniczy należy podawać w odstępach co najmniej sześciogodzinnych.
Nie należy stosować większej dawki produktu niż zalecana.
Działania niepożądane można ograniczyć, stosując najmiejszą skuteczną dawkę przez najkrótszy okres konieczny do złagodzenia objawów (patrz punkt 4.4).
Należy stosować najmniejszą skuteczną dawkę przez najkrótszy okres konieczny do złagodzenia objawów (patrz punkt 4.4).
Bez konsultacji z lekarzem nie stosować dłużej niż 3 dni.
U niemowląt w wieku 3 - 5 miesięcy w przypadku nasilenia się objawów lub jeśli objawy utrzymują się dłużej niż 24 godziny, należy natychmiast zasięgnąć opinii lekarza.
W przypadku dzieci w wieku powyżej 6 miesięcy i u młodzieży, należy zasięgnąć porady lekarza, jeśli podawanie leku jest konieczne przez więcej niż 3 dni lub jeśli objawy ulegają nasileniu.
Do opakowania dołączona jest strzykawka doustna. Sposób podawania
Podanie doustne. Przed użyciem butelkę należy wstrząsnąć.
Instrukcja dawkowania przy pomocy strzykawki doustnej z korkiem umieszczonym w szyjce butelki:
Należy zachować ostrożność u pacjentów z niektórymi schorzeniami, których przebieg może ulec pogorszeniu:
Należy rozważyć monitorowanie parametrów klinicznych i biologicznych u pacjentów przyjmujących ibuprofen w skojarzeniu z produktami leczniczymi wymienionymi poniżej.
Nie zaleca się skojarzonego stosowania z następującymi produktami leczniczymi:
Ciąża
Hamowanie syntezy prostaglandyn może wpływać niekorzystnie na przebieg ciąży i (lub) rozwój zarodka lub płodu. Dane z badań epidemiologicznych wskazują na zwiększone ryzyko poronienia, wystąpienia wad rozwojowych serca i przewodu pokarmowego u płodu podczas stosowania terapii inhibitorami syntezy prostaglandyn we wczesnym okresie ciąży. Ryzyko bezwzględnego wystąpienia wad układu sercowo-naczyniowego zwiększyło się z mniej niż 1% do około 1,5%. Wydaje się, że ryzyko to zwiększa się wraz z dawką i czasem trwania leczenia. U zwierząt, podawanie inhibitorów syntezy prostaglandyn powoduje utratę ciąży w trakcie fazy przedimplantacyjnej oraz poimplantacyjnej zarodka, a także śmiertelność zarodka lub płodu. Ponadto podawanie inhibitorów syntezy prostaglandyn w okresie organogenezy płodu wiązało się ze zwiększoną częstością występowania różnych wad rozwojowych, z wadami układu krążenia włącznie.
Od 20. tygodnia ciąży stosowanie ibuprofenu może powodować małowodzie spowodowane zaburzeniami czynności nerek płodu. Może ono wystąpić krótko po rozpoczęciu leczenia i zwykle ustępuje po jego przerwaniu. Ponadto, zgłaszano przypadki zwężenia przewodu tętniczego po leczeniu w drugim trymestrze, z których większość ustąpiła po zaprzestaniu leczenia. W związku z tym, ibuprofenu nie należy podawać podczas pierwszego i drugiego trymestru ciąży, chyba że jest to bezwzględnie konieczne. Jeśli ibuprofen ma być podany kobiecie planującej ciążę lub kobiecie będącej w pierwszym lub drugim trymestrze ciąży, należy zastosować najmniejszą możliwą skuteczną dawkę oraz najkrótszy możliwy okres stosowania produktu.
Kilka dni po 20. tygodniu ciąży należy rozważyć przedporodową obserwację w celu wykrycia małowodzia i zwężenia przewodu tętniczego po narażeniu na produkt leczniczy IBUM FORTE. W razie stwierdzenia małowodzia lub zwężenia przewodu tętniczego należy zaprzestać stosowania produktu IBUM FORTE.
Podczas trzeciego trymestru ciąży wszystkie inhibitory syntezy prostaglandyn mogą narażać płód na wystąpienie:
W związku z tym produkt leczniczy IBUM FORTE jest przeciwwskazany w trzecim trymestrze ciąży (patrz punkty 4.3 i 5.3).
Karmienie piersią
Ibuprofen i jego metabolity przenikają do mleka kobiet karmiących piersią w niewielkiej ilości (0,0008% zastosowanej dawki). W przypadku krótkotrwałego przyjmowania ibuprofenu w dawkach stosowanych w leczeniu bólu i gorączki, szkodliwy wpływ na niemowlęta wydaje się mało prawdopodobny. Jeśli jednak zalecane jest dłuższe przyjmowanie ibuprofenu, należy rozważyć wcześniejsze zakończenie karmienia piersią.
Płodność
Istnieją dowody na to, że substancje hamujące cyklooksygenazę (enzym biorący udział w syntezie prostaglandyn) mogą powodować zaburzenia płodności u kobiet przez wpływ na owulację. Działanie to jest przemijające i ustępuje po zakończeniu terapii.
Krótkotrwałe stosowanie produktu nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Częstość występowania działań niepożądanych określono zgodnie z konwencją MedDRA: bardzo często (≥1/10), często (1/100 do <1/10), niezbyt często (1/1000 do <1/100), rzadko (1/10 000 do
<1/1000) i bardzo rzadko (<1/10 000), częstość nieznana (częstość nie może być określona na podstawie dostępnych danych).
Lista następujących działań niepożądanych obejmuje wszystkie znane działania niepożądane, które wystąpiły w trakcie leczenia ibuprofenem, również te u pacjentów z chorobami reumatycznymi leczonych długotrwale dużymi dawkami.
Zakażenia i zarażenia pasożytnicze
Bardzo rzadko zostało opisane zaostrzenie stanów zapalnych związanych z zakażeniem (np. rozwój martwiczego zapalenia powięzi) skojarzone z niesteroidowymi lekami przeciwzapalnymi. Jest to prawdopodobnie związane z mechanizmem działania niesteroidowych leków przeciwzapalnych.
Należy zalecić pacjentowi, aby natychmiast skontaktował się z lekarzem jeśli objawy zakażenia wystąpią lub pogorszą się w trakcie stosowania produktu IBUM FORTE. Należy zbadać czy istnieją wskazania do leczenia przeciwzakaźnego lub terapii antybiotykami. Objawy aseptycznego zapalenia opon mózgowych ze sztywnością karku, bólem głowy, nudnościami, wymiotami, gorączką lub zaburzeniami świadomości obserwowano bardzo rzadko podczas stosowania ibuprofenu. Osobami podatnymi wydają się być pacjenci z chorobami autoimmunologicznymi (SLE, choroba mieszana tkanki łącznej).
Zaburzenia krwi i układu chłonnego
Bardzo rzadko: zaburzenia układu krwiotwórczego (niedokrwistość, leukopenia, trombocytopenia, pancytopenia, agranulocytoza). Pierwsze objawy to: gorączka, ból gardła, powierzchowne owrzodzenia jamy ustnej, objawy grypopodobne, znaczne zmęczenie, krwawienia z nosa i skóry.
Zaburzenia układu immunologicznego
Niezbyt często: reakcje nadwrażliwości z wysypką skórną i świądem, a także ataki astmy (z możliwością zmniejszenia ciśnienia tętniczego krwi).
Należy pouczyć pacjenta, aby w takim przypadku natychmiast poinformował lekarza i zaprzestał przyjmowania produktu IBUM FORTE.
Bardzo rzadko: ciężkie ogólne reakcje nadwrażliwości. Mogą one występować jako obrzęk twarzy, obrzęk języka, obrzęk krtani z wewnętrznym zwężeniem dróg oddechowych, dolegliwość układu oddechowego, kołatanie serca, spadek ciśnienia krwi do wstrząsu zagrażającego życiu.
Jeśli jeden z tych objawów wystąpi, co może się zdarzyć nawet podczas pierwszego użycia produktu, należy natychmiast zgłosić się do lekarza.
Zaburzenia psychiczne
Bardzo rzadko: reakcje psychotyczne, depresja.
Zaburzenia układu nerwowego
Niezbyt często: zaburzenia ośrodkowego układu nerwowego, takie jak bóle głowy, zawroty głowy, bezsenność, pobudzenie, drażliwość i zmęczenie.
Zaburzenia oka
Niezbyt często: zaburzenia widzenia.
Zaburzenia ucha i błędnika
Rzadko: szumy uszne.
Zaburzenia serca
Bardzo rzadko: kołatanie serca, niewydolność serca, zawał mięśnia sercowego, obrzęk, nadciśnienie tętnicze i niewydolność serca.
Badania kliniczne wskazują, że stosowanie ibuprofenu, zwłaszcza w dużej dawce (2400 mg na dobę), może być związane z niewielkim wzrostem ryzyka wystąpienia tętniczych incydentów zatorowo- zakrzepowych (np. zawału mięśnia sercowego lub udaru mózgu) (patrz punkt 4.4).
Zaburzenia naczyniowe
Bardzo rzadko: nadciśnienie tętnicze.
Zaburzenia żołądka i jelit
Najczęściej obserwowane działania niepożądane są w obrębie przewodu pokarmowego. Może wystąpić choroba wrzodowa żołądka, perforacja lub krwawienie z przewodu pokarmowego, czasem ze skutkiem śmiertelnym, zwłaszcza u pacjentów w podeszłym wieku (patrz punkt 4.4). Nudności, wymioty, biegunka, wzdęcia, zaparcia, niestrawność, bóle brzucha, smoliste stolce, krwawe wymioty, wrzodziejące zapalenie błony śluzowej jamy ustnej, zaostrzenie zapalenia jelita grubego i choroba Crohna (patrz punkt 4.4) były zgłaszane po podaniu ibuprofenu. Rzadziej obserwowano zapalenie błony śluzowej żołądka.
Często: zaburzenia żołądka i jelit, takie jak zgaga, bóle brzucha, nudności, wymioty, wzdęcia, biegunki, zaparcia i niewielkie krwawienia w przewodzie pokarmowym, które w wyjątkowych przypadkach mogą powodować niedokrwistość.
Niezbyt często: owrzodzenie przewodu pokarmowego z możliwym krwawieniem i perforacją, wrzodziejące zapalenie jamy ustnej, zaostrzenie zapalenia jelita grubego i choroba Crohna (patrz punkt 4.4), zapalenie błony śluzowej żołądka.
Bardzo rzadko: zapalenie przełyku, zapalenie trzustki, tworzenie się przeponopodobnych zwężeń w jelitach.
Pacjent powinien zostać pouczony, że należy przerwać stosowanie produktu i natychmiast skontaktować się z lekarzem, w przypadku wystąpienia silnego bólu w nadbrzuszu, krwawych wymiotów lub smolistych stolców.
Zaburzenia wątroby i dróg żółciowych
Bardzo rzadko: zaburzenia czynności wątroby, uszkodzenie wątroby, zwłaszcza w terapii długotrwałej, niewydolność wątroby, ostre zapalenie wątroby.
Zaburzenia skóry i tkanki podskórnej
Bardzo rzadko: ciężkie postacie reakcji skórnych, takie jak rumień wielopostaciowy, reakcje pęcherzowe, w tym zespół Stevensa-Johnsona i toksyczne martwicze oddzielanie się naskórka, Wyjątkowo mogą wystąpić ciężkie zakażenia skóry i tkanki miękkiej skóry jako powikłania podczas ospy wietrznej.
Częstość nieznana: reakcja polekowa z eozynofilią i objawami ogólnymi (zespół DRESS), ostra uogólniona osutka krostkowa (AGEP), reakcje nadwrażliwości na światło.
Zaburzenia nerek i dróg moczowych
Bardzo rzadko: zmniejszenie wydalania mocznika, obrzęk szczególnie u pacjentów z nadciśnieniem tętniczym. Ponadto niewydolność nerek, zespół nerczycowy, śródmiąższowe zapalenie nerek, którym może towarzyszyć ostra niewydolność nerek, martwica brodawek, zwłaszcza podczas długotrwałego stosowania, zwiększenie stężenia mocznika w surowicy.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Aleje Jerozolimskie 181C, 02 - 222 Warszawa, tel.: + 48 22 49 21 301, faks: + 48 22 49 21 309,
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy przedawkowania
Objawy przedawkowania mogą obejmować nudności, wymioty, ból brzucha, ból głowy, zawroty głowy, senność, oczopląs, zaburzenia widzenia, szumy uszne i rzadko spadek ciśnienia krwi, niewydolność nerek i utratę przytomności. W ciężkim zatruciu może wystąpić kwasica metaboliczna. Leczenie przedawkowania
Nie istnieje specyficzne antidotum.
Pacjenci w razie potrzeby powinni być leczeni objawowo. Należy zastosować leczenie uzupełniające w razie potrzeby.
Grupa farmakoterapeutyczna: leki przeciwzapalne i przeciwreumatyczne, pochodne kwasu propionowego, kod ATC: M 01AE 01
IBUM FORTE należy do niesteroidowych leków przeciwzapalnych z grupy fenylopropionowych pochodnych kwasu arylokarboksylowego. Działa przeciwzapalnie, przeciwbólowo i przeciwgorączkowo. Mechanizm działania ibuprofenu, podobnie jak innych niesteroidowych leków przeciwzapalnych, polega na hamowaniu syntezy prostaglandyn i w mniejszym stopniu – tromboksanu i prostacyklin - poprzez hamowanie aktywności enzymu cyklooksygenazy. Ibuprofen wykazuje także zdolność odwracalnego hamowania agregacji płytek krwi.
Dane doświadczalne wskazują, że ibuprofen może kompetycyjnie hamować działanie małych dawek kwasu acetylosalicylowego polegające na hamowaniu agregacji płytek krwi, gdy leki te są podawane jednocześnie. Niektóre badania farmakologiczne wykazały, że po podaniu pojedynczej dawki ibuprofenu (400 mg) w ciągu 8 godzin przed podaniem dawki kwasu acetylosalicylowego o natychmiastowym uwalnianiu (81 mg) lub 30 minut po podaniu, występuje osłabienie wpływu kwasu acetylosalicylowego na powstawanie tromboksanu lub agregację płytek. Pomimo braku pewności, czy dane te można ekstrapolować do sytuacji klinicznych, nie można wykluczyć, że regularne, długotrwałe stosowanie ibuprofenu może ograniczać działanie kardioprotekcyjne małych dawek kwasu acetylosalicylowego. Uważa się, że sporadyczne przyjmowanie ibuprofenu nie ma istotnego znaczenia klinicznego (patrz punkt 4.5).
Wchłanianie
Wchłanianie leku następuje w żołądku i jelicie cienkim. Maksymalne stężenie leku w osoczu osiągane jest w ciągu 90 minut od podania.
Dystrybucja
Ibuprofen wiąże się w 99% z białkami osocza. Okres półtrwania w organizmie wynosi około 2 godzin. Stężenie leku w mazi stawowej na poziomie stałym stwierdza się pomiędzy 2. a 8. godziną po przyjęciu produktu leczniczego.
Metabolizm
Ibuprofen metabolizowany jest w 90% do nieczynnych metabolitów.
Eliminacja
Ibuprofen wydalany jest z organizmu wraz z moczem w ciągu 24 godzin od podania ostatniej dawki produktu leczniczego. Wydalany jest w 90% jako metabolity nieczynne - glukuronidy i w 10% w postaci niezmienionej.
W badaniach na zwierzętach, toksyczne działanie ibuprofenu obserwowano jako zmiany i owrzodzenia w przewodzie pokarmowym. Ibuprofen nie wykazywał właściwości mutagennych in vitro oraz rakotwórczych w badaniach przeprowadzonych u szczurów i myszy. Badania doświadczalne wykazały, że ibuprofen przenika przez łożysko, ale brak dowodów na jakiekolwiek działanie teratogenne.
Maltitol ciekły (E 965)
Glicerol (E 422) Guma ksantan
Sacharyna sodowa (E 954) Sodu benzoesan (E 211) Kwas fumarowy
Disodu fosforan dwunastowodny
Aromat truskawkowy naturalny AR 2157 (zawiera naturalne substancje aromatyczne oraz glikol propylenowy E 1520)
Woda oczyszczona
Nie wykazano niezgodności chemicznych ani fizycznych z innymi produktami leczniczymi.
3 lata
Po pierwszym otwarciu: 6 miesięcy.
Przechowywać w zamkniętym oryginalnym opakowaniu, w temperaturze poniżej 25°C.
Butelka ze szkła brunatnego (sodowo-wapniowo-krzemianowego, typ III, barwy brunatnej) o pojemności 100 ml, zamknięta zakrętką polietylenową z korkiem i pierścieniem gwarancyjnym, w tekturowym pudełku wraz z ulotką dla pacjenta i strzykawką doustną (strzykawkę stanowi: cylinder z polietylenu PE i tłok z polistyrenu PS).
1 butelka po 100 g
Bez specjalnych wymagań.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
„PRZEDSIĘBIORSTWO PRODUKCJI FARMACEUTYCZNEJ HASCO-LEK” S.A.
51-131 Wrocław, ul. Żmigrodzka 242E Tel.: + 48 71 352 95 22
Fax: + 48 71 352 76 36
Pozwolenie nr 22798
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 18 listopada 2015 r. Data ostatniego przedłużenia pozwolenia: 22 grudnia 2021 r.
10.01.2023 r.











