Spis treści:
- Co to jest Multimel N6-900 E i w jakim celu się go stosuje
- Informacje ważne przed podaniem leku Multimel N6-900 E Kiedy nie stosować leku Multimel N6-900 E:
- Jak podawać Multimel N6-900 E
- Możliwe działania niepożądane
- Jak przechowywać lek Multimel N6-900 E
- Zawartość opakowania i inne informacje Co zawiera lek Multimel N6-900 E
Ulotka dołączona do opakowania: informacja dla użytkownika Multimel N6-900 E, emulsja do infuzji
Należy zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
W razie jakichkolwiek dalszych wątpliwości należy zwrócić się do lekarza lub pielęgniarki.
Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce należy powiedzieć o tym lekarzowi lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki:
Co to jest Multimel N6-900 E i w jakim celu się go stosuje
Multimel N6-900 E jest emulsją do infuzji. Pakowany jest w trójkomorowy worek.
Pierwsza komora zawiera roztwór glukozy z wapniem, druga komora zawiera emulsję tłuszczową, a trzecia komora zawiera roztwór aminokwasów z elektrolitami.
Grupa farmakoterapeutyczna: płyny do żywienia pozajelitowego/mieszaniny.
Multimel N6-900 E jest podawany w celu dożylnego odżywiania przez rurkę dorosłych oraz dzieci w wieku powyżej 2 lat, gdy odżywianie doustne nie jest odpowiednie.
Multimel N6-900 E należy podawać wyłącznie pod nadzorem lekarza.
Informacje ważne przed podaniem leku Multimel N6-900 E Kiedy nie stosować leku Multimel N6-900 E:
w przypadku wcześniaków, niemowląt i dzieci w wieku poniżej 2 lat;
jeśli pacjent ma uczulenie na jaja, soję, białka orzeszków ziemnych, kukurydzę/produkty zawierające kukurydzę (patrz również punkt „Ostrzeżenia i środki ostrożności” poniżej) lub którykolwiek z pozostałych składników leku Multimel N6-900 E;
jeśli stosowanie niektórych aminokwasów wywołuje nieprawidłową reakcję organizmu pacjenta;
jeśli u pacjenta występuje szczególnie duże stężenie tłuszczów we krwi (hiperlipidemia);
o ciężkich chorobach nerek. Należy także poinformować lekarza, jeśli pacjent jest poddawany dializie (sztuczna nerka) lub innym metodom oczyszczania krwi;
o ciężkiej chorobie wątroby;
o zaburzeniach krzepliwości krwi;
o nieprawidłowej pracy nadnerczy (niewydolność nadnerczy). Nadnercza to gruczoły o trójkątnym kształcie, znajdujące się na szczycie nerek;
o niewydolności serca;
o chorobie płuc;
o gromadzeniu się wody w organizmie (przewodnienie);
o niewystarczającej ilości wody w organizmie (odwodnienie);
o nieleczonym wysokim stężeniu glukozy we krwi (cukrzyca);
o zawale mięśnia sercowego lub wstrząsie spowodowanym nagłą niewydolnością serca;
o ciężkiej kwasicy metabolicznej (zbyt kwasowy odczyn krwi);
o uogólnionym zakażeniu (posocznica);
o śpiączce.
Jeśli pacjentem jest dziecko, lekarz będzie uważnie sprawdzał stan płynów i (lub) parametry krwi.
Podczas stosowania leku Multimel i podobnych leków zgłaszano występowanie zespołu przeciążenia tłuszczami. Zmniejszona lub ograniczona zdolność organizmu do usuwania tłuszczów zawartych w leku Multimel N6-900 E może skutkować „zespołem przeciążenia tłuszczami” (patrz punkt 4 —
„Możliwe działania niepożądane”).
Nie należy wprowadzać dodatkowych składników do worka bez wcześniejszego sprawdzenia ich zgodności. Mogłoby to spowodować powstanie cząstek lub zaburzenie stabilności emulsji tłuszczowej. To może wywołać niedrożność naczyń krwionośnych.
Jeśli stężenie glukozy we krwi zwiększy się nadmiernie, lekarz powinien dostosować szybkość podawania leku Multimel N6-900 E lub podać pacjentowi insulinę.
W przypadkach ciężkiego niedożywienia wymagającego podawania składników odżywczych dożylnie, zaleca się, aby żywienie pozajelitowe rozpoczynać powoli i z zachowaniem ostrożności.
Przed rozpoczęciem infuzji należy skorygować zaburzenia równowagi wodno-elektrolitowej oraz zaburzenia metaboliczne pacjenta. Lekarz będzie monitorował stan pacjenta w czasie terapii i może zmienić dawkowanie lub, jeśli uzna to za stosowne, zalecić dodatkowe składniki odżywcze, takie jak witaminy, elektrolity i pierwiastki śladowe.
W trakcie podawania leku lekarz przeprowadzi badania kliniczne i laboratoryjne, aby sprawdzić skuteczność i na bieżąco kontrolować bezpieczeństwo podawania leku. Jeśli pacjent otrzymuje lek przez wiele tygodni, badania krwi będą wykonywane regularnie. Badania te są szczególnie wymagane w przypadku niektórych chorób, takich jak niewydolność wątroby, niewydolność nerek, choroba w której aminokwasy nie mogą być prawidłowo przetwarzane przez organizm, choroba w której krew ma zbyt kwaśny odczyn, choroba w której stężenie tłuszczów i cholesterolu jest większe niż normalnie, cukrzyca, niedokrwistość lub trudności z hamowaniem krwawienia.
Jeśli podczas infuzji wystąpi ból, pieczenie, sztywność, obrzęk lub przebarwienia skóry w miejscu infuzji lub wyciek infuzji, należy powiedzieć o tym lekarzowi lub pielęgniarce. Podawanie zostanie natychmiast przerwane i wznowione w innej żyle.
Dzieci
Jeśli pacjentem jest dziecko, należy zachować szczególną uwagę, aby podać prawidłową dawkę. Wymagana może być dodatkowa podaż witamin i pierwiastków śladowych, zależnie od stosowanej dawki i czasu podawania. Z powodu zwiększonej wrażliwości dzieci na ryzyko infekcji trzeba podjąć również wzmożone środki ostrożności.
Multimel N6-900E a inne leki
Należy powiedzieć lekarzowi lub pielęgniarce o wszystkich lekach przyjmowanych przez pacjenta obecnie lub ostatnio a także o lekach, które pacjent planuje przyjmować.
Nie wolno podawać leku Multimel N6-900 E jednocześnie z krwią przez ten sam zestaw do infuzji.
Multimel N6-900 E zawiera wapń. Nie należy go podawać razem z antybiotykiem o nazwie ceftriakson lub przez tą sama rurkę, gdyż mogą powstać cząstki. Jeśli stosowany jest ten sam zestaw do padawania tych leków pacjentowi, kolejno jeden lek po drugim, zestaw musi być dokładnie przepłukany.
Olej z oliwek oraz olej sojowy obecne w leku Multimel N6-900 E zawierają witaminę K. Zazwyczaj
nie ma to wpływu na działanie leków rozrzedzających krew (przeciwzakrzepowych), takich jak kumaryna. Jeśli jednak pacjent przyjmuje leki przeciwzakrzepowe, powinien poinformować o tym lekarza.
Tłuszcze zawarte w tej emulsji mogą zaburzać wyniki niektórych badań laboratoryjnych, o ile próbki krwi zostały pobrane zanim doszło do eliminacji tłuszczów (tłuszcze są zazwyczaj eliminowane po ok. 5-6 godzinach od zaprzestania ich podawania).
Multimel N6-900 E z elektrolitami zawiera potas. Należy zachować szczególną ostrożność w przypadku pacjentów przyjmujących leki moczopędne, inhibitory konwertazy angiotensyny (ACE), antagonistów receptora angiotensyny II (leki stosowane w nadciśnieniu) lub leki immunosupresyjne. Leki tego rodzaju mogą spowodować wzrost stężenia potasu we krwi.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć dziecko, powinna poradzić się lekarza przed zastosowaniem tego leku.
Jak podawać Multimel N6-900 E
Możliwe działania niepożądane
reakcje alergiczne
Częstość: nieznana (nie może być określona na podstawie dostępnych danych)
zwężenie dróg oddechowych, świszczący oddech i (lub) kaszel (skurcz oskrzeli, jako element reakcji alergicznej)
drżenie
biegunka, nudności, wymioty
nienaturalne zaczerwienienie skóry (rumień), nadmierne pocenie się
ból kończyn, skurcze mięśni
wyciek infuzji do otaczających tkanek (wynaczynienie), który może spowodować opuchnięcie/obrzęk w miejscu infuzji, ból, podrażnienie i zapalenie żyły, zaczerwienienie/ ciepło, miejscowy ubytek tkanki, martwicę tkanki lub pęcherze
gorączka, dreszcze, stan zapalny
zmniejszona lub ograniczona zdolność do usuwania tłuszczów zawartych w leku Multimel N6-900 E może wywołać „zespół przeciążenia tłuszczami”. Może on być wynikiem przedawkowania, ale może także wystąpić już na początku infuzji, nawet w przypadku podawania leku zgodnie z instrukcją. Wiąże się to z nagłym pogorszeniem klinicznego stanu pacjenta. Charakteryzuje się wysoką zawartością tłuszczów we krwi, gorączką, stłuszczeniem wątroby (wysoka zawartość tłuszczu w wątrobie) i (lub) powiększeniem wątroby. Może również wystąpić niedokrwistość (zmniejszenie liczby czerwonych krwinek, co może skutkować bladym zabarwieniem skóry, osłabieniem lub zadyszką), zmniejszenie liczby krwinek białych i płytek krwi, zaburzenie krzepliwości krwi i (lub) śpiączka. Zespół ten zazwyczaj ustępuje po zaprzestaniu infuzji emulsji tłuszczowej.
Dla podobnych leków zgłaszano następujące działania niepożądane:
Częstość nieznana (nie może być określona na podstawie dostępnych danych)
powstawanie niewielkich cząstek, co może prowadzić do zablokowania naczyń krwionośnych w płucach (osad w naczyniach płucnych), powodując wystąpienie płucnego zatoru naczyniowego i trudności w oddychaniu (niewydolność oddechowa)
spadek liczby płytek krwi (zmniejszenie liczby krwinek odpowiedzialnych za krzepnięcie krwi, co powoduje krwawienia, takie jak krwawienie z nosa)
trudności z wydalaniem żółci (cholestaza), powiększenie wątroby, żółtaczka (zażółcenie skóry lub białka oczu spowodowane zaburzeniami dotyczącymi wątroby lub krwi)
nadwrażliwość
zwiększenie aktywności enzymów wątrobowych, zwiększenie stężenia tłuszczów we krwi (zwiększenie stężenia triglicerydów we krwi), zwiększenie stężenia bilirubiny we krwi
zwiększenie stężenia azotu we krwi (azotemia)
U dzieci odnotowano przypadki zmniejszenia liczby białych krwinek i płytek krwi.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w ulotce, należy powiedzieć o tym lekarzowi lub pielęgniarce. Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181 C PL 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Jak przechowywać lek Multimel N6-900 E
Zawartość opakowania i inne informacje Co zawiera lek Multimel N6-900 E
SKŁAD ILOŚCIOWY
DAWKOWANIE I SPOSÓB PODAWANIA
SPECJALNE OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI DOTYCZĄCE STOSOWANIA
Nie podawać przez żyłę obwodową.
Zbyt szybkie podawanie płynów do całkowitego żywienia pozajelitowego, w tym produktu Multimel N6-900 E, może skutkować poważnymi lub śmiertelnymi powikłaniami.
W razie wystąpienia objawów lub oznak reakcji alergicznej (takich jak pocenie się, gorączka, dreszcze, ból głowy, wysypka na skórze, duszność lub skurcz oskrzeli) wlew należy natychmiast przerwać. Produkt zawiera olej sojowy oraz fosfatydy jaja kurzego. Białka soi oraz jaja mogą powodować reakcje nadwrażliwości. Obserwowano krzyżowe reakcje alergiczne pomiędzy białkami soi i orzeszków ziemnych.
Produkt Multimel N6-900 E zawiera glukozę uzyskaną z kukurydzy, która może powodować reakcje nadwrażliwości u pacjentów z alergią na kukurydzę lub produkty zawierające kukurydzę.
Przed rozpoczęciem wlewu należy skorygować ciężkie zaburzenia gospodarki wodno- elektrolitowej, ciężkie stany przeciążenia płynami oraz ciężkie zaburzenia metaboliczne.
Na początku każdego wlewu dożylnego konieczny jest specjalny nadzór kliniczny.
Nie wolno mieszać lub podawać ceftriaksonu jednocześnie z dożylnymi roztworami zawierającymi wapń, nawet przez różne linie do infuzji lub różne miejsca infuzji. Ceftriakson i roztwory zawierające wapń mogą być podawane kolejno jeden po drugim, jeśli stosuje się linie do infuzji w różnych miejscach lub jeśli linie do infuzji są wymieniane lub dokładnie przepłukiwane pomiędzy infuzjami za pomocą roztworu fizjologicznego soli, w celu uniknięcia tworzenia osadów. U pacjentów wymagających ciągłego podawania infuzji roztworów do całkowitego żywienia parenteralnego zawierających wapń, lekarze mogą rozważyć zastosowanie alternatywnego leczenia przeciwbakteryjnego, nie niosącego podobnego ryzyka tworzenia osadów. Jeśli zastosowanie ceftriaksonu jest konieczne u pacjentów wymagających ciągłego żywienia, roztwory do całkowitego żywienia parenteralnego mogą być podane jednocześnie, aczkolwiek przez różne linie do infuzji w różnych miejscach wkłucia. Alternatywnie, wlew roztworu do całkowitego żywienia parenteralnego może być wstrzymany na okres infuzji ceftriaksonu, z uwzględnieniem zasady dotyczącej przepłukania linii do infuzji pomiędzy roztworami (patrz punkt 4, „Interakcje” i „Niezgodności”).
U pacjentów otrzymujących żywienie pozajelitowe zgłaszano odkładanie osadów w naczyniach płucnych, powodujące zatorowość naczyń płucnych i niewydolność płucną. W niektórych przypadkach wystąpił zgon. Nadmierny dodatek wapnia i fosforanu zwiększa ryzyko powstawania osadu fosforanu wapnia (patrz punkt 4, „Niezgodności").
Zgłaszano również przypadki podejrzenia formowania się osadu w krwiobiegu.
Oprócz kontroli roztworu, należy również okresowo sprawdzać zestaw do infuzji i cewnik w kierunku obecności osadów.
W przypadku wystąpienia objawów niewydolności płucnej, infuzję należy przerwać i przeprowadzić badanie lekarskie.
Nie należy dodawać innych produktów leczniczych ani substancji do którejkolwiek z komór worka ani do gotowej emulsji, bez wcześniejszego sprawdzenia ich zgodności oraz stabilności
otrzymanej mieszaniny (w szczególności stabilności emulsji tłuszczowej). Powstanie osadów lub destabilizacja emulsji tłuszczowej może spowodować okluzję naczyń.
Zakażenie dostępu żylnego i sepsa są powikłaniami, które mogą wystąpić u pacjentów otrzymujących żywienie pozajelitowe, szczególnie w przypadku niewystarczającej dbałości o cewniki, immunosupresyjnych skutków choroby lub leków. Dokładne monitorowanie oznak, objawów oraz wyników badań laboratoryjnych celem wykrycia gorączki/dreszczy, leukocytozy, komplikacji technicznych związanych ze sprzętem do dostępu żylnego oraz hiperglikemii może pomóc we wczesnym rozpoznawaniu zakażenia. Pacjenci wymagający żywienia pozajelitowego często są predysponowani do powikłań infekcyjnych z powodu niedożywienia i (lub) stanu związanego z chorobą zasadniczą. Występowanie powikłań septycznych można zmniejszyć poprzez zwiększenie nacisku na stosowanie technik aseptycznych podczas umieszczania i utrzymywania cewnika oraz w trakcie przygotowywania produktu do żywienia.
Przez cały okres leczenia należy monitorować równowagę wodno-elektrolitową, osmolarność surowicy, stężenie triglicerydów w surowicy, równowagę kwasowo-zasadową, stężenie glukozy we krwi oraz przeprowadzać testy czynnościowe wątroby i nerek, testy krzepnięcia i liczby komórek krwi, w tym płytek krwi.
Jeśli ilość przyjmowanych substancji odżywczych nie jest dostosowana do potrzeb pacjenta lub pojemność metaboliczna któregokolwiek ze składników żywieniowych nie jest dokładnie oceniona, mogą wystąpić nieprawidłowości metaboliczne. Niepożądane skutki metaboliczne mogą wynikać z podania nadmiernej ilości lub niewłaściwych substancji odżywczych lub też z niewłaściwej kompozycji dodatkowych składników względem potrzeb danego pacjenta.
Należy systematycznie sprawdzać stężenia triglicerydów w surowicy oraz zdolność organizmu do usuwania tłuszczów.
Stężenia triglicerydów w surowicy nie powinny podczas wlewu przekraczać 3 mmol/l. Pomiar tych stężeń należy wykonywać nie wcześniej niż po 3 godzinach ciągłego wlewu.
W przypadku podejrzenia nieprawidłowości w metabolizmie tłuszczów, zaleca się codzienne wykonywanie pomiaru stężenia triglicerydów w surowicy po 5 - 6 godzinach bez podawania tłuszczów. U dorosłych, surowica powinna zostać oczyszczona w ciągu poniżej 6 godzin po zaprzestaniu wlewu emulsji tłuszczowej. Kolejny wlew można rozpocząć dopiero wtedy, gdy stężenie triglicerydów w surowicy wróci do wartości prawidłowych.
Podczas stosowania produktu Multimel i podobnych produktów opisywano występowanie zespołu przeciążenia tłuszczami. Zmniejszona lub ograniczona zdolność metabolizowania tłuszczów zawartych w produkcie Multimel N6-900 E może skutkować wystąpieniem „zespołu przeciążenia tłuszczami” spowodowanego przedawkowaniem, jednak oznaki i objawy tego zespołu mogą pojawić się również przy podawaniu produktu zgodnie z zaleceniami.
W przypadku wystąpienia hiperglikemii należy dostosować szybkość infuzji produktu Multimel N6-900 E i (lub) podać insulinę.
W przypadku wprowadzania dodatkowych składników, przed podaniem należy zmierzyć ostateczną osmolarność mieszaniny. Uzyskaną mieszaninę należy podawać do żyły centralnej lub obwodowej, w zależności od jej ostatecznej osmolarności. Jeśli końcowa mieszanina jest hipertoniczna, przy podawaniu przez żyłę obwodową może dojść do podrażnienia żyły.
Mimo naturalnej obecności w produkcie pierwiastków śladowych i witamin, ich ilość jest niewystarczająca, by pokryć zapotrzebowanie organizmu. Dlatego należy je dodawać w celu zapobieżenia powstaniu niedoborów. Należy zapoznać się z instrukcjami dotyczącymi wprowadzania dodatkowych składników do produktu.
Należy zachować ostrożność podczas podawania produktu Multimel N6-900 E pacjentom z podwyższoną osmolarnością, niewydolnością nadnerczy, niewydolnością serca lub zaburzeniami płuc.
Uzupełnianie substancji odżywczych u pacjentów ciężko niedożywionych może wywołać zespół objawów z tym związanych, który charakteryzuje się przeniesieniem potasu, fosforu i magnezu do przestrzeni wewnątrzkomórkowej, gdyż u pacjenta zaczynają przeważać przemiany anaboliczne. Może także dojść do powstania niedoboru tiaminy i zatrzymania płynów w organizmie. Dokładna kontrola i powolne zwiększanie podaży substancji odżywczych, unikając przekarmienia może zapobiec tym komplikacjom. Ten zespół odnotowano w przypadku podobnych produktów.
Nie podłączać worków seryjnie, aby uniknąć zatorów powietrznych, spowodowanych resztkowym powietrzem zawartym w pierwszym worku.
Niewydolność wątroby
Należy zachować ostrożność stosując produkt u pacjentów z niewydolnością wątroby, ponieważ istnieje ryzyko rozwoju lub nasilenia zaburzeń neurologicznych związanych z hiperamonemią. Należy regularnie przeprowadzać badania kliniczne i laboratoryjne, w szczególności parametrów czynności wątroby, stężenia glukozy, elektrolitów oraz triglicerydów we krwi.
Niewydolność nerek
Należy zachować ostrożność stosując produkt u pacjentów z niewydolnością nerek, szczególnie w przypadku występowania hiperkaliemii, gdyż istnieje ryzyko rozwoju lub nasilenia kwasicy metabolicznej oraz hiperazotemii, jeśli nie wykonuje się dodatkowego usuwania produktów metabolizmu wydalanych przez nerki. U tych pacjentów należy uważnie monitorować stan płynów i elektrolitów oraz stężenie triglicerydów.
Hematologia
Należy zachować ostrożność stosując produkt u pacjentów z zaburzeniami krzepnięcia oraz niedokrwistością. Należy uważnie monitorować morfologię krwi i parametry krzepliwości.
Endokrynologia i metabolizm
Należy zachować ostrożność stosując produkt u pacjentów, u których występują:
kwasica metaboliczna. Nie zaleca się podawania wodorowęglanów w przypadku kwasicy mleczanowej. Należy regularnie przeprowadzać badania kliniczne i laboratoryjne;
cukrzyca. Należy monitorować stężenie glukozy we krwi i w moczu, ketonurię i w razie
potrzeby dostosować dawkowanie insuliny;
hiperlipidemia spowodowana obecnością tłuszczów w emulsji do infuzji. Należy regularnie przeprowadzać badania kliniczne i laboratoryjne;
zaburzenia metabolizmu aminokwasów.
Wynaczynienie
Miejsce, w którym został założony cewnik należy regularnie kontrolować w celu wykrycia objawów wynaczynienia. Jeśli wystąpi wynaczynienie, podawanie należy natychmiast zatrzymać, utrzymując założony cewnik lub kaniulę w miejscu do natychmiastowego wdrożenia leczenia. Jeśli to możliwe, należy wykonać aspirację przez założony cewnik/kaniulę w celu zmniejszenia ilości płynu obecnego w tkankach, zanim cewnik/kaniula zostanie usunięty.
W zależności od produktu, który uległ wynaczynieniu (właczając produkt(-y) zmieszany z produktem Multimel N6-900 E, jeśli dotyczy) oraz stopnia/zakresu urazu, należy podjąć odpowiednie środki. Opcje postępowania mogą obejmować interwencję niefarmakologiczną, farmakologiczną i (lub) chirurgiczną. W przypadku pogorszenia dotkniętego obszaru (ciągły ból, martwica, owrzodzenie, podejrzewany zespół przedziału), należy niezwłocznie przeprowadzić konsultację chirurgiczną.
Miejsce wynaczynienia należy monitorować co najmniej co 4 godziny w ciągu pierwszych 24 godzin, a następnie raz na dobę.
Infuzji nie należy wznawiać w tej samej żyle centralnej. Specjalne ostrzeżenia dotyczące leczenia dzieci i młodzieży
Przy podawaniu dzieciom w wieku powyżej 2 lat jest ważne, aby użyć worka o pojemności odpowiadającej dawce dobowej.
Zawsze konieczna jest dodatkowa podaż witamin i pierwiastków śladowych. Należy stosować produkty o składzie dostosowanym do grupy wiekowej pediatrycznej.
PRAKTYCZNE INFORMACJE DOTYCZĄCE PRZYGOTOWANIA DO STOSOWANIA PRODUKTU LECZNICZEGO ORAZ USUWANIA JEGO POZOSTAŁOŚCI
worek nie jest uszkodzony
spawy nie są uszkodzone
gdy roztwory aminokwasów i glukozy są przezroczyste, bezbarwne lub lekko żółte, praktycznie nie zawierają widocznych cząstek
emulsja tłuszczowa jest homogennym płynem o mlecznym wyglądzie.
Przed użyciem należy doprowadzić produkt Multimel N6-900 E do temperatury pokojowej.
Podawać dopiero po rozerwaniu spawów dzielących 3 komory worka i wymieszaniu zawartości 3 komór, jak pokazano niżej.
Należy się upewnić, że gotowa emulsja do infuzji nie wykazuje cech rozdzielania faz.
1.

2.
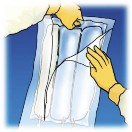
3.

Rozerwać opakowanie ochronne
Usunąć przednią część
Umieścić worek na płaskiej,
od góry.
opakowania ochronnego, aby
poziomej i czystej powierzchni
odsłonić worek
uchwytem do siebie.
Multimel N6-900 E. Wyrzucić
opakowanie ochronne i saszetkę
pochłaniającą tlen.
4.
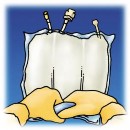
5.
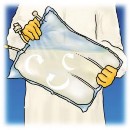
6.
Unieść worek trzymając za uchwyt, aby usunąć płyn z górnej części worka.
Zdecydowanie zrolować worek oburącz zaczynając od góry worka, aż do momentu rozerwania spawów (mniej
więcej do połowy ich długości).
Wymieszać zawartość worka, obracając go co najmniej 3- krotnie. Należy się upewnić, że mieszanina jest jednorodna i że nie następuje rozdzielanie faz.
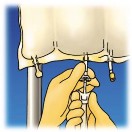
Zawiesić worek. Usunąć
plastikową osłonkę z miejsca przeznaczonego do wkłucia ostrza zestawu do przetaczania. Wcisnąć w nie mocno ostrze zestawu do przetaczania.
Po otwarciu worka zawartość należy użyć natychmiast. Nie wolno przechowywać otwartego worka do kolejnego wlewu.
Nie podłączać ponownie częściowo zużytych worków.
Nie podłączać worków seryjnie, aby uniknąć zatorów powietrznych, spowodowanych resztkowym gazem zawartym w pierwszym worku.
Wyłącznie do jednorazowego użycia. Wszelkie resztki niewykorzystanego produktu lub jego odpady oraz cały zestaw do infuzji należy zniszczyć.
Nie należy przechowywać częściowo zużytych worków i wyrzucić wszystkie składniki zestawu po użyciu.
Dodatkowe składniki
Nie należy dodawać innych produktów lub substancji leczniczych do którejkolwiek z komór worka lub do gotowej emulsji bez uprzedniego sprawdzenia ich zgodności i stabilności powstałej mieszaniny (zwłaszcza stabilności emulsji tłuszczowej).
Multimel N6-900 E może być stosowany bez wprowadzania składników dodatkowych lub też w razie potrzeby po dodaniu elektrolitów, pierwiastków śladowych lub witamin.
Pojemność worka jest wystarczająca, aby umożliwić wprowadzenie dodatkowych składników, takich jak witaminy, elektrolity i pierwiastki śladowe. Wszystkie dodatkowe składniki (włączając witaminy) mogą być wprowadzane do gotowej emulsji (powstałej po rozerwaniu spawów i zmieszaniu zawartości 3 komór).
Witaminy mogą być również dodane do komory z roztworem glukozy przed sporządzeniem gotowej emulsji (przed rozerwaniem spawów i zmieszaniem roztworów i emulsji).
W przypadku wprowadzania dodatkowych składników do produktu, przed podaniem do żyły obwodowej należy zmierzyć ostateczną osmolarność mieszaniny.
Do produktu Multimel N6-900 E można dodawać:
elektrolity: należy uwzględnić ilość elektrolitów już zawartych w worku; wykazano stabilność mieszaniny zawierającej łącznie do 150 mmol sodu, 150 mmol potasu, 5,6 mmol magnezu, 5 mmol wapnia na 1 litr trzyskładnikowej mieszaniny;
fosforany organiczne: wykazano stabilność mieszaniny zawierającej do 15 mmol dodanych fosforanów na worek.
Pierwiastki śladowe i witaminy: wykazano stabilność po dodaniu dostępnych na rynku produktów witamin i pierwiastków śladowych (zawierających maksymalnie 1 mg żelaza). Zgodność z innymi dodatkowymi składnikami jest dostępna na życzenie.
Dodatkowe składniki muszą być wprowadzone przez wykwalifikowany personel w warunkach aseptycznych.
Składniki dodatkowe wprowadza się przez miejsce do wstrzykiwań używając igły:
przygotować miejsce do wstrzykiwań;
wbić igłę w miejsce do wstrzykiwań i wstrzyknąć;
wymieszać zawartość worka z dodanymi składnikami.
OKRES WAŻNOŚCI
lata, jeśli opakowanie ochronne nie jest uszkodzone.
Zaleca się, aby produkt został użyty niezwłocznie po otwarciu spawów rozdzielających zawartości
komór. Wykazano jednak, że gotowa emulsja zachowuje stabilność do 7 dni w temperaturze od +2C do +8C i następnie przez kolejne 48 godzin w temperaturze nieprzekraczającej +25C.
- jeśli u pacjenta występuje ciężka hiperglikemia (zbyt duże stężenie cukru we krwi);
- jeśli we krwi pacjenta występuje nieprawidłowo duża zawartość któregokolwiek z elektrolitów (sodu, potasu, magnezu, wapnia i (lub) fosforu).
W każdym przypadku lekarz podejmie decyzję o podaniu leku na podstawie czynników takich jak wiek, masa ciała pacjenta i jego stan kliniczny, uwzględniając wyniki przeprowadzonych badań.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem przyjmowania leku Multimel N6-900 E należy omówić to z lekarzem lub
pielęgniarką.
Zbyt szybkie podawanie roztworów do całkowitego żywienia pozajelitowego może skutkować zgonem.
W razie wystąpienia nietypowych objawów lub oznak reakcji alergicznej, takich jak gorączka, dreszcze, wysypka skórna lub trudności w oddychaniu, nadmierne pocenie, nudności i ból głowy, wlew należy natychmiast przerwać. Lek zawiera olej sojowy oraz fosfatydy jaja kurzego. Białka soi oraz jaja mogą wywoływać reakcje nadwrażliwości. Obserwowano krzyżowe reakcje alergiczne pomiędzy białkami soi i orzeszków ziemnych.
Lek Multimel N6-900 E zawiera glukozę uzyskaną z kukurydzy, która może powodować reakcje nadwrażliwości, jeśli pacjent ma uczulenie na kukurydzę lub produkty zawierające kukurydzę (patrz punkt „Kiedy nie stosować leku Multimel N6-900 E” powyżej).
Trudności w oddychaniu mogą być również objawem powstawania niewielkich cząstek, blokujących naczynia krwionośne w płucach (osad w naczyniach płucnych). Należy powiedzieć lekarzowi lub pielęgniarce o wystąpieniu jakichkolwiek trudności w oddychaniu. Zadecydują oni o postępowaniu, jakie należy podjąć.
Antybiotyk ceftriakson nie może być mieszany lub podawany jednocześnie z jakimkolwiek roztworem zawierającym wapń i podawanym w kroplówce do żyły (włączając Multimel N6-900 E).
Te leki nie mogą być podawane równocześnie nawet przez różne linie do infuzji lub różne miejsca wkłucia.
Jednakże, Multimel N6-900 E i ceftriakson mogą być podane kolejno jeden po drugim, jeśli linie do infuzji zostaną wymienione lub zostały dokładnie przepłukane roztworem fizjologicznym soli pomiędzy infuzjami, aby uniknąć wytrącenia osadu (tworzenie cząstek soli ceftriakson-wapń).
Lekarz będzie sprawdzał i monitorował stężenie triglicerydów (rodzaj tłuszczów występujących we krwi).
Niektóre leki oraz choroby mogą zwiększyć ryzyko rozwoju zakażenia lub posocznicy (obecność bakterii we krwi). Szczególne ryzyko wystąpienia zakażenia lub posocznicy istnieje po umieszczeniu rurki (cewnika dożylnego) w żyle pacjenta. Lekarz będzie uważnie obserwował pacjenta celem wykrycia jakichkolwiek objawów zakażenia. Pacjenci wymagający żywienia pozajelitowego (podawania substancji odżywczych za pomocą rurki umieszczonej w żyle) mogą być ze względu na swój stan kliniczny bardziej narażeni na rozwój zakażenia. Stosowanie techniki aseptycznej (wolnej od zarazków) podczas umieszczania i utrzymywania cewnika oraz podczas przygotowania leku do żywienia może zmniejszyć ryzyko zakażenia.
Lekarza należy poinformować:
Multimel N6-900 E można podawać wyłącznie dorosłym oraz dzieciom w wieku powyżej 2 lat.
Jest to emulsja do infuzji podawana przez plastikową rurkę wyłącznie do dużej żyły w klatce piersiowej pacjenta.
Leczenie można kontynuować tak długo, jak to jest potrzebne, zależnie od stanu klinicznego pacjenta. Multimel N6-900 E jest przeznaczony wyłącznie do jednorazowego użycia.
Dawkowanie – Dorośli
Dawkowanie ustala lekarz w zależności od indywidualnych potrzeb i klinicznego stanu pacjenta.
Maksymalna dawka dobowa wynosi 40 ml/kg masy ciała. Na przykład: dla pacjenta o wadze 70 kg maksymalna dawka dobowa nie powinna przekroczyć 2800 ml emulsji do infuzji (40 ml emulsji do infuzji pomnożone przez 70 kg).
Dawkowanie - Dzieci w wieku powyżej 2 lat
Dawka leku stosowana u dziecka oraz okres jej podawania są ustalane przez lekarza. Zależy to od wieku, masy ciała, wzrostu, stanu klinicznego, dziennej objętości płynów oraz zapotrzebowania na energię i zapotrzebowania na azot.
Przyjęcie większej niż zalecana dawki leku Multimel N6-900 E
W przypadku podania pacjentowi zbyt dużej dawki leku lub zbyt szybkiej infuzji, zawarte aminokwasy mogą przyczynić się do zwiększenia kwasowości krwi i zwiększenia objętości płynu w układzie krążenia. Glukoza zawarta w leku może zwiększyć stężenie glukozy we krwi i w moczu, a zawarte w emulsji tłuszcze mogą zwiększyć stężenie triglicerydów we krwi. Podanie zbyt dużej objętości leku Multimel N6-900 E może wywołać nudności, wymioty, dreszcze, ból w klatce piersiowej, ból głowy, nieregularne lub przyspieszone bicie serca oraz zaburzenia elektrolitowe. W takiej sytuacji należy natychmiast przerwać infuzję.
W niektórych ciężkich przypadkach, aby wspomóc nerki pacjenta w wydaleniu nadmiaru leku, lekarz może zastosować okresowo leczenie z zastosowaniem dializy.
Aby zapobiec takim sytuacjom, lekarz regularnie monitoruje stan pacjenta oraz sprawdza parametry krwi.
W razie wątpliwości związanych ze stosowaniem leku należy zwrócić się do lekarza.
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią. W przypadku zaobserwowania jakichkolwiek zmian samopoczucia podczas leczenia lub po jego zakończeniu, należy od razu powiadomić o tym lekarza lub pielęgniarkę.
Badania przeprowadzane przez lekarza podczas stosowania leku mają na celu zminimalizowanie ryzyka działań niepożądanych.
Jeśli wystąpią jakiekolwiek nietypowe oznaki lub objawy reakcji alergicznej, takie jak podwyższona temperatura ciała, dreszcze, wysypka skórna lub problemy z oddychaniem, nadmierne pocenie się, nudności i ból głowy, należy natychmiast przerwać infuzję.
Podczas stosowania leku Multimel zgłoszono występowanie następujących działań niepożądanych:
Niezbyt często (może dotyczyć do 1 na 100 pacjentów):
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na pojemniku oraz opakowaniu zewnętrznym. Termin ważności oznacza ostatni dzień danego miesiąca.
Nie zamrażać.
Przechowywać w opakowaniu ochronnym.
Przechowywać w kartonie zewnętrznym w celu ochrony przed światłem.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać farmaceutę jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko.
Substancje czynne znajdujące się w każdym worku z gotową emulsją:
Substancje czynne | 1000 ml | 1500 ml | 2000 ml | 2500 ml |
Oczyszczony olej z oliwek oraz oczyszczony olej sojowy* | 40,00 g | 60,00 g | 80,00 g | 100,00 g |
L-alanina | 7,04 g | 10,56 g | 14,08 g | 17,60 g |
L-arginina | 3,91 g | 5,87 g | 7,82 g | 9,78 g |
Glicyna | 3,50 g | 5,26 g | 7,01 g | 8,76 g |
L-histydyna | 1,63 g | 2,45 g | 3,26 g | 4,08 g |
L-izoleucyna | 2,04 g | 3,06 g | 4,08 g | 5,10 g |
L-leucyna | 2,48 g | 3,73 g | 4,97 g | 6,21 g |
L-lizyna | 1,97 g | 2,96 g | 3,94 g | 4,93 g |
(co odpowiada chlorowodorkowi lizyny) | (2,46 g) | (3,70 g) | (4,93 g) | (6,16 g) |
L-metionina | 1,36 g | 2,04 g | 2,72 g | 3,40 g |
L-fenyloalanina | 1,90 g | 2,86 g | 3,81 g | 4,76 g |
L-prolina | 2,31 g | 3,47 g | 4,62 g | 5,78 g |
L-seryna | 1,70 g | 2,55 g | 3,40 g | 4,25 g |
L-treonina | 1,43 g | 2,14 g | 2,86 g | 3,57 g |
L-tryptofan | 0,61 g | 0,92 g | 1,22 g | 1,53 g |
L-tyrozyna | 0,14 g | 0,20 g | 0,27 g | 0,34 g |
L-walina | 1,97 g | 2,96 g | 3,94 g | 4,93 g |
Sodu octan trójwodny | 2,45 g | 3,67 g | 4,90 g | 6,12 g |
Sodu glicerofosforan pięciowodny | 2,14 g | 3,22 g | 4,29 g | 5,36 g |
Potasu chlorek | 1,79 g | 2,68 g | 3,58 g | 4,47 g |
Magnezu chlorek sześciowodny | 0,45 g | 0,67 g | 0,90 g | 1,12 g |
Glukoza (co odpowiada glukozie jednowodnej) | 120,00 g (132,00 g) | 180,00 g (198,00 g) | 240,00 g (264,00 g) | 300,00 g (330,00 g) |
Wapnia chlorek dwuwodny | 0,30 g | 0,44 g | 0,59 g | 0,74 g |
Wartość energetyczna całkowita (kcal) | 1015 | 1525 | 2030 | 2540 |
Wartość energetyczna niebiałkowa (kcal) | 880 | 1320 | 1760 | 2200 |
*Mieszanina oczyszczonego oleju z oliwek (ok. 80%) i oczyszczonego oleju sojowego (ok. 20%)
Pozostałe składniki to oczyszczone fosfatydy jaja kurzego, glicerol, sodu oleinian, sodu wodorotlenek, lodowaty kwas octowy, kwas solny, woda do wstrzykiwań.
Jak wygląda lek Multimel N6-900 E i co zawiera opakowanie
Multimel N6-900 E jest emulsją do infuzji dostarczaną w 3-komorowym worku, który jest wielowarstwowym workiem plastikowym. Wewnętrzna (kontaktowa) warstwa worka jest wykonana z polimerów (mieszaniny kopolimerów poliolefinowych) i wykazuje zgodność z zawartością worka (roztworami aminokwasów, roztworami glukozy i emulsjami tłuszczowymi) i dozwolonymi dodatkami oraz pozwala na stworzenie rozrywalnych spawów. Polimery użyte do wykonania powlekającej warstwy wytworzone są z EVA (octanu polietylenowinylu) i kopoliestru.
Przed zmieszaniem zawartości 3 komór worka, pierwsza komora zawiera jednorodny płyn o mlecznym wyglądzie (emulsję tłuszczową), podczas gdy dwie pozostałe komory (zawierające roztwór aminokwasów z elektrolitami i roztwór glukozy z wapniem) zawierają bezbarwne lub lekko żółte roztwory, praktycznie bez widocznych cząstek. Po zmieszaniu Multimel N6-900 E jest emulsją do infuzji o wyglądzie jednorodnego mleczno-białego płynu.
Worek jest umieszczony w opakowaniu ochronnym, zabezpieczającym przed dostępem tlenu, które zawiera saszetkę pochłaniającą tlen.
Wielkość opakowań
worek 1000 ml: 6 worków w tekturowym pudełku worek 1500 ml: 4 worki w tekturowym pudełku worek 2000 ml: 4 worki w tekturowym pudełku worek 2500 ml: 2 worki w tekturowym pudełku
Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny:
W celu uzyskania informacji dotyczących leku Multimel N6-900 E należy skontaktować się z
przedstawicielem podmiotu odpowiedzialnego:
Baxter Polska Sp. z o.o. ul. Kruczkowskiego 8
00-380 Warszawa
Wytwórca:
Baxter S.A.
Boulevard René Branquart 80 7860 Lessines
Belgia
Data ostatniej aktualizacji ulotki: 06.03.2020
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Multimel N6-900 E, emulsja do infuzji
Po zmieszaniu zawartości 3 komór mieszanina ma postać jednorodnej emulsji o mlecznym wyglądzie. Gotowa emulsja po zmieszaniu zawiera następujące składniki w workach o różnej wielkości:
Na worek | 1000 ml | 1500 ml | 2000 ml | 2500 ml |
Azot (g) | 5,6 | 8,4 | 11,2 | 14,0 |
Aminokwasy (g) | 34 | 51 | 68 | 85 |
Glukoza (g) | 120 | 180 | 240 | 300 |
Tłuszcze (g) | 40 | 60 | 80 | 100 |
Wartość energetyczna całkowita (kcal) | 1015 | 1525 | 2030 | 2540 |
Wartość energetyczna niebiałkowa (kcal) | 880 | 1320 | 1760 | 2200 |
Wartość energetyczna glukozy (kcal) | 480 | 720 | 960 | 1200 |
Wartość energetyczna tłuszczów (kcal) | 400 | 600 | 800 | 1000 |
Wartość energetyczna niebiałkowa/zawartość azotu (kcal/gN) | 157 | 157 | 157 | 157 |
Sód (mmol) | 32 | 48 | 64 | 80 |
Potas (mmol) | 24 | 36 | 48 | 60 |
Magnez (mmol) | 2,2 | 3,3 | 4,4 | 5,5 |
Wapń (mmol) | 2 | 3 | 4 | 5 |
Fosforany (mmol)** | 10 | 15 | 20 | 25 |
Octany (mmol) | 53 | 79 | 106 | 132 |
Chlorki (mmol) | 46 | 69 | 92 | 115 |
pH | 6 | 6 | 6 | 6 |
Osmolarność (mOsm/l) | 1160 | 1160 | 1160 | 1160 |
** Łącznie z fosforanami zawartymi w emulsji tłuszczowej
Dawkowanie ustala się w zależności od wydatku energetycznego, stanu klinicznego pacjenta, masy ciała oraz możliwości metabolizowania składników produktu Multimel N6-900 E, jak również od
składników energetycznych lub białek, dodatkowo dostarczanych doustnie/dojelitowo; dlatego też należy odpowiednio dobrać wielkość worka.
Podawanie można kontynuować tak długo, jak wymaga tego stan kliniczny pacjenta.
Nie należy przekraczać maksymalnej dawki dobowej u dorosłych ani u dzieci i młodzieży. Z powodu ustalonego składu worka wielokomorowego, równoczesne spełnienie wszystkich potrzeb żywieniowych pacjenta może nie być możliwe. Może wystąpić sytuacja kliniczna, w której pacjent będzie wymagać innej ilości składników odżywczych niż dostępne w stałym składzie worka.
Jako ogólna zasada, nie należy przekraczać dawki 3 g aminokwasów/kg mc. na dobę i (lub) 17 g glukozy/kg mc. na dobę i (lub) 3 g tłuszczów/kg mc. na dobę i (lub) 100 ml płynu/kg mc. na dobę, z wyjątkiem szczególnych przypadków.
Multimel przeznaczony jest wyłącznie do jednorazowego użytku.
Zalecany czas trwania wlewu w przypadku żywienia pozajelitowego wynosi od 12 do 24 godzin.
Dawkowanie i szybkość infuzji – Dorośli
Przeciętne zapotrzebowanie na azot wynosi od 0,16 do 0,35 g/kg mc. na dobę (ok. 1 do 2 g aminokwasów/kg mc. na dobę).
Zapotrzebowanie energetyczne waha się zależnie od stanu odżywienia pacjenta i poziomu katabolizmu. Średnio wynosi ono od 20 do 40 kcal/kg mc. na dobę.
Maksymalna dawka dobowa:
Dla produktu Multimel N6-900 E: Maksymalna dawka dobowa wynosi 40 ml/kg mc. (co odpowiada 1,36 g aminokwasów, 4,8 g glukozy, 1,6 g tłuszczów, 1,28 mmoli sodu i 0,96 mmoli potasu/kg mc.), tj. 2800 ml emulsji do infuzji dla pacjenta ważącego 70 kg.
Maksymalna szybkość wlewu
Jako ogólna zasada, nie należy przekraczać szybkości wlewu 0,10 g aminokwasów/kg mc. na godzinę i (lub) 0,25 g glukozy/kg mc. na godzinę i (lub) 0,15 g tłuszczów/kg mc. na godzinę, z wyjątkiem szczególnych przypadków.
Dla produktu Multimel N6-900 E: Jako ogólna zasada, nie należy przekraczać szybkości wlewu 2 ml/kg mc. na godzinę, tj. 0,07 g aminokwasów, 0,24 g glukozy i 0,08 g tłuszczów/kg mc. na godzinę.
Dawkowanie i szybkość infuzji – Dzieci w wieku powyżej 2 lat i młodzież
Nie przeprowadzano badań u dzieci i młodzieży.
Dawkowanie ustala się zależnie od ilości przyjmowanych płynów i dobowego zapotrzebowania na azot.
Podaż powinna być skorygowana z uwzględnieniem stanu nawodnienia dziecka. Dobowe zapotrzebowanie na płyny, azot i energię stale maleje wraz z wiekiem.
Wytyczne dotyczące maksymalnej zalecanej szybkości infuzji na godzinę i objętości na dobę dla dzieci i młodzieży to:
Multimel N6-900 E:
Maksymalna dawka dobowa:
Składnik | 2 do 11 lat | 12 do 18 lat | ||
Zalecana maksymalna dawka dobowaa | Maksymalna dawka dobowa MULTIMEL N6-900 Eb | Zalecana maksymalna dawka dobowaa | Maksymalna dawka dobowa MULTIMEL N6-900 Eb | |
Płyny (ml/kg mc./dobe) | 60 – 120 | 45 | 50 – 80 | 45 |
Aminokwasy (g/kg mc./dobę) | 1 – 2 (do 2,5) | 1,5 | 1 – 2 | 1,5 |
Glukoza (g/kg mc./dobę) | 1,4 – 8,6 | 5,4 | 0,7 – 5,8 | 5,4 |
Tłuszcze (g/kg mc./dobę) | 0,5 – 3 | 1,8 | 0,5 – 2 (do 3) | 1,8 |
Wartość energetyczna całkowita (kcal/kg mc./dobę) | 30-75 | 45,7 | 20-55 | 45,7 |
Sód (mmol/kg mc./dobę) | 1-3 | 1,4 | 1-3 | 1,4 |
Potas (mmol/kg mc./dobę) | 1-3 | 1,1 | 1-3 | 1,1 |
a: Zalecane wartości z Wytycznych ESPGHAN/ESPEN/ESPR 2018
b: Stężenie magnezu jest czynnikiem ograniczającym maksymalną dawkę dobową w obu grupach wiekowych
Maksymalna szybkość na godzinę
Składnik | 2 do 11 lat | 12 do 18 lat | ||
Zalecana maksymalna szybkość na godzinęa | Maksymalna szybkość na godzinę MULTIMEL N6-900 Eb | Zalecana maksymalna szybkość na godzinęa | Maksymalna szybkość na godzinę MULTIMEL N6-900 Eb | |
Płyny (ml/kg mc./godz.) | Nie dotyczy | 3,0 | Nie dotyczy | 2,0 |
Aminokwasy (g/kg mc./godz.) | 0,20 | 0,10 | 0,12 | 0,06 |
Glukoza (g/kg mc./godz.) | 0,36 | 0,36 | 0,24 | 0,24 |
Tłuszcze (g/kg mc./godz.) | 0,13 | 0,12 | 0,13 | 0,08 |
a: Zalecane wartości z Wytycznych ESPGHAN/ESPEN/ESPR 2018
b: Stężenie glukozy jest czynnikiem ograniczającym maksymalną szybkość na godzinę w obu grupach wiekowych
Droga podania
Multimel N6-900 E należy podawać dożylnie przez żyłę centralną.
Szybkość wlewu należy dostosować do wielkości podawanej dawki, charakterystyki końcowej mieszaniny, całkowitej objętości przewidzianej do przetoczenia w ciągu doby i czasu trwania wlewu.
Multimel N6-900 E należy stosować wyłącznie jeśli:
Interakcje z innymi lekami
Nie przeprowadzano badań interakcji z produktem Multimel.
Multimel N6-900 E zawiera witaminę K, naturalnie obecną w emulsjach tłuszczowych. Ilość witaminy K w zalecanych dawkach produktu Multimel N6-900 E nie powinna mieć wpływu na działanie pochodnych kumaryny.
Nie wolno mieszać lub podawać ceftriaksonu jednocześnie z podawanymi dożylnie roztworami zawierającymi wapń, w tym z produktem Multimel N6-900 E, przez tą samą linię do infuzji, ze względu na ryzyko wytrącenia się soli wapniowych ceftriaksonu.
Ceftriakson i roztwory zawierajace wapń mogą być podawane kolejno jeden po drugim, jeśli stosuje się linie do infuzji w różnych miejscach lub jeśli linie do infuzji są wymieniane lub dokładnie przepłukiwane pomiędzy infuzjami za pomocą roztworu fizjologicznego soli, w celu uniknięcia tworzenia osadów.
Ze względu na zawartość potasu w produkcie Multimel N6-900 E, należy zachować szczególną ostrożność stosując go u pacjentów leczonych diuretykami oszczędzającymi potas (np. amiloryd, spironolakton, triamteren), inhibitorami konwertazy angiotensyny (ACE), antagonistami receptora angiotensyny II lub lekami immunosupresyjnymi: takrolimus i cyklosporyna, z powodu ryzyka hiperkaliemii.
Tłuszcze zawarte w tej emulsji mogą zaburzać wyniki niektórych badań laboratoryjnych (np. oznaczenia bilirubiny, dehydrogenazy mleczanowej, wysycenia tlenem, hemoglobiny krwinkowej), o ile próbki krwi zostały pobrane zanim doszło do eliminacji tłuszczów (tłuszcze są zazwyczaj eliminowane po upływie ok. 5-6 godzin od zaprzestania ich podawania).
Niezgodności farmaceutyczne
Nie wolno podawać tej emulsji do infuzji jednocześnie z krwią przez ten sam zestaw do infuzji.
Multimel N6-900 E zawiera jony wapnia, które stanowią dodatkowe ryzyko koagulacji i powstania osadów w antykoagulowanej/konserwowanej cytrynianami krwi lub składnikach krwi.
Przyczyną niezgodności może być na przykład zbyt duża kwasowość (niskie pH) lub nieodpowiednia zawartość kationów dwuwartościowych (Ca2+ i Mg2+), co może wpłynąć niekorzystnie na stabilność emulsji tłuszczowej.
Jak w przypadku wszelkich mieszanin do żywienia pozajelitowego, należy uwzględnić zawartości wapnia i fosforu. Nadmierny dodatek wapnia lub fosforu, zwłaszcza w postaci soli mineralnych, może prowadzić do formowania osadów fosforanu wapnia.
Należy sprawdzić zgodność produktu z roztworami, które są podawane jednocześnie przez ten sam zestaw do infuzji, cewnik lub kaniulę.
Nie wolno mieszać lub podawać ceftriaksonu jednocześnie z podawanymi dożylnie roztworami zawierającymi wapń, w tym z produktem Multimel N6-900 E, przez tą samą linię do infuzji (np. złącze typu Y), ze względu na ryzyko wytrącenia się soli wapniowych ceftriaksonu (patrz punkt
„Interakcje”).
Po wprowadzeniu dodatkowych składników (elektrolitów, pierwiastków śladowych, witamin) gotowa emulsja Multimel N6-900 E (patrz poprzednia sekcja) zachowuje stabilność chemiczną i fizyczną przez 7 dni w temperaturze od 2C do 8C i następnie przez kolejne 48 godzin w temperaturze poniżej 25C. Z mikrobiologicznego punktu widzenia, każda gotowa mieszanina zawierająca dodatkowe składniki powinna zostać natychmiast zużyta. W przeciwnym razie, za czas i warunki przechowywania mieszaniny do czasu użycia odpowiada użytkownik. Jednak mieszaniny tak sporządzonej nie powinno się przechowywać dłużej niż 24 godziny w temperaturze 2-8C, chyba że wprowadzenie dodatkowych składników odbywało się w kontrolowanych i zwalidowanych warunkach aseptycznych.











