Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ(-CH) I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA(-I) I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRESY KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
- INNE INFORMACJE
ULOTKA INFORMACYJNA
Virbactan 150 mg maść dowymieniowa dla krów w okresie zasuszenia
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNEJ(-CH) I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA(-I) I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
Wyczyść strzyk załączoną chusteczką do dezynfekcji
Podanie płytkie - usunąć końcówkę zatyczki, zgodnie z rysunkiem
Podanie głębokie - usunąć całą zatyczkę, zgodnie z rysunkiem
OKRESY KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
INNE INFORMACJE
Podmiot odpowiedzialny:
VIRBAC
1ère avenue, 2065 m, LID 06516 Carros
Francja
Wytwórca odpowiedzialny za zwolnienie serii:
VIRBAC
1ère avenue, 2065 m, LID 06516 Carros
Francja
HAUPT PHARMA LATINA
S.S.156 dei Monti Lepini - Km. 47,600 04100 Borgo San Michele – Latina Włochy
Virbactan 150 mg maść dowymieniowa Cefquinom (w postaci siarczanu)
Każda strzykawka (3 g) produktu Virbactan zawiera:
Substancja czynna
Cefquinom (w postaci siarczanu) 150,0 mg
Maść dowymieniowa
Homogenna, biaława, oleista maść.
Do leczenia podklinicznych postaci zapaleń wymienia w okresie zasuszenia i w celu zapobiegania nowym zakażeniom bakteryjnym wymienia w okresie zasuszania krów mlecznych, wywoływanym przez następujące wrażliwe na cefquinom mikroorganizmy: Streptococcus uberis, Streptococcus dysgalactiae, Streptococcus agalactiae, Staphylococcus aureus, gronkowce koagulazoujemne.
Nie stosować u zwierząt o znanej nadwrażliwości na cefalosporyny i inne antybiotyki β-laktamowe. Nie stosować u krów w przebiegu klinicznej postaci zapalenia wymienia.
W bardzo rzadkich przypadkach po podaniu cefalosporyn u zwierząt mogą wystąpić reakcje nadwrażliwości.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
Można również zgłosić działania niepożądane poprzez krajowy system raportowania (www.urpl.gov.pl).
Bydło (krowy w okresie zasuszenia)
Jednokrotne podanie dowymieniowe 150 mg cefquinomu.
Zawartość jednej strzykawki należy delikatnie wprowadzić do strzyku każdej ćwiartki gruczołu mlekowego, niezwłocznie po ostatnim udoju.
Przed zastosowaniem należy całkowicie opróżnić gruczoł mlekowy. Strzyk i okolice otworu strzykowego należy dokładnie wyczyścić i zdezynfekować załączoną chusteczką. Należy zwrócić uwagę, aby nie dopuścić do zanieczyszczenia końcówki strzykawki. Delikatnie wprowadzić około 5 mm lub całą długość końcówki i podać zawartość całej strzykawki do każdej ćwiartki. Rozprowadzić produkt delikatnie masując strzyk i wymię.
Strzykawka może być użyta wyłącznie jednokrotnie.
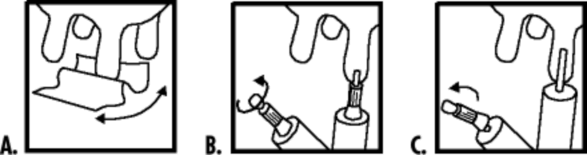
Nie dotykać końcówki strzykawki palcami. Maść podawać z zachowaniem ostrożności.
Tkanki jadalne: 2 dni
Mleko: 1 dzień po wycieleniu, gdy okres zasuszenia jest dłuższy niż 5 tygodni 36 dni, gdy okres zasuszenia wynosi 5 tygodni lub mniej
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Nie przechowywać w temperaturze powyżej 25°C.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na opakowaniu, po EXP. Termin ważności oznacza ostatni dzień danego miesiąca.
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt:
Brak
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Produkt należy stosować w oparciu o wyniki badań lekowrażliwości bakterii izolowanych od zwierząt. Jeśli jest to niemożliwe, leczenie powinno być oparte na lokalnych (regionalnych, na poziomie fermy) danych epidemiologicznych dotyczących lekowrażliwości bakterii docelowych.
Nie stosować chusteczek na strzykach z uszkodzoną skórą.
W przypadku omyłkowego zastosowania w okresie laktacji, mleka nie należy przeznaczać do spożycia przez 35 dni.
Skuteczność produktu została potwierdzona tylko w odniesieniu do patogenów wymienionych w punkcie „Wskazania lecznicze”. Zatem ostre zapalenia wymienia (potencjalnie śmiertelne) spowodowane innymi patogenami, głównie Pseudomonas aeruginosa, mogą pojawić się w okresie zasuszenia. Celem zminimalizowania tego ryzyka należy zapewnić odpowiedni poziom higieny, krowy powinny przebywać na czystym wybiegu oddalonym od części udojowej, powinny być regularnie badane kilka dni po okresie zasuszenia.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Penicyliny i cefalosporyny mogą powodować występowanie reakcji nadwrażliwości (alergii) w przypadku wstrzyknięcia, dostania się do układu oddechowego, spożycia lub kontaktu ze skórą. Nadwrażliwość na penicyliny może prowadzić do wystąpienia nadwrażliwości krzyżowej na cefalosporyny i odwrotnie. Reakcje alergiczne na te substancje mogą mieć niekiedy poważny przebieg. Osoby o znanej nadwrażliwości na penicyliny lub cefalosporyny, lub którym zalecono unikanie kontaktu z takimi produktami, nie powinny mieć do czynienia z tym produktem.
Należy obchodzić się z produktem ze szczególną ostrożnością, w celu uniknięcia ekspozycji. Stosować nieprzepuszczalne rękawiczki podczas podawania produktu i obchodzenia się z produktem. Umyć skórę narażoną na kontakt z produktem.
Jeżeli po zastosowaniu produktu wystąpią objawy, takie jak świąd skóry, należy zwrócić się o pomoc lekarską oraz przedstawić lekarzowi niniejsze ostrzeżenie. Obrzęk twarzy, warg i oczu lub trudności w oddychaniu są poważniejszymi objawami i wymagają udzielenia niezwłocznej pomocy lekarskiej. Osoby, u których po kontakcie z produktem występują objawy nadwrażliwości, powinny unikać kontaktu z produktem (oraz innymi produktami zawierającymi cefalosporyny i penicyliny).
Umyć ręce po zastosowaniu chusteczek do dezynfekcji strzyków i stosować rękawiczki ochronne, jeżeli podejrzewa się lub występuje nadwrażliwość na alkohol izopropylowy. Unikać kontaktu z oczami, ponieważ alkohol izopropylowy może wywoływać podrażnienie oczu.
Ciąża, laktacja:
Brak jest dowodów działania toksycznego na funkcje rozrodcze bydła (włączając działanie teratogenne). Badania laboratoryjne prowadzone u szczurów i królików nie wykazały występowania działania teratogennego, czy działania toksycznego na płód i organizm matki.
Produkt jest przeznaczony do stosowania w okresie ciąży. W przebiegu badań klinicznych nie obserwowano występowania działań niepożądanych na płody.
Nie stosować podczas laktacji.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Oddziaływanie hamujące antybiotyków bakteriostatycznych (makrolidy, sulfonamidy i tetracykliny) na działanie bakteriobójcze cefquinomu nie zostało dotychczas oszacowane. Zatem nie są dostępne informacje dotyczące bezpieczeństwa i skuteczności takiego rodzaju oddziaływania.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki): Nie dotyczy.
Główne niezgodności farmaceutyczne:
Nieznane
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
24/09/2021
Pudełko zawierające 1 saszetkę z 4 strzykawkami i 4 chusteczki do dezynfekcji. Pudełko zawierające 5 saszetek z 4 strzykawkami i 20 chusteczek do dezynfekcji. Pudełko zawierające 6 saszetek z 4 strzykawkami i 24 chusteczki do dezynfekcji. Pudełko zawierające 15 saszetek z 4 strzykawkami i 60 chusteczek do dezynfekcji. Pudełko zawierające 30 saszetek z 4 strzykawkami i 120 chusteczek do dezynfekcji.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego:
VIRBAC Sp. z o.o.
ul. Puławska 314
02-819 Warszawa
Tel.: + 48 22 855 40 46











