Spis treści:
- Co to jest SmofKabiven Peripheral i w jakim celu się go stosuje
- Informacje ważne przed zastosowaniem leku SmofKabiven Peripheral Nie stosować leku SmofKabiven Peripheral, jeśli u pacjenta występuje:
- Jak stosować SmofKabiven Peripheral
- Możliwe działania niepożądane
- Jak przechowywać SmofKabiven Peripheral
- Zawartość opakowania i inne informacje Co zawiera SmofKabiven Peripheral Substancjami czynnymi leku są:
Ulotka dołączona do opakowania: informacja dla użytkownika SmofKabiven Peripheral, emulsja do infuzji
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki
Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy
niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
Co to jest SmofKabiven Peripheral i w jakim celu się go stosuje
SmofKabiven Peripheral jest emulsją do infuzji, podawaną pacjentowi w kroplówce (infuzja dożylna). Opakowanie leku stanowi worek plastikowy, który zawiera aminokwasy (składniki niezbędne do tworzenia białek), glukozę (węglowodany), tłuszcze (lipidy) i sole (elektrolity). Lek może być stosowany u dorosłych i dzieci w wieku 2 lat i powyżej.
Fachowy personel medyczny podaje SmofKabiven Peripheral, jeśli inne sposoby żywienia są niewystarczające lub niemożliwe.
Informacje ważne przed zastosowaniem leku SmofKabiven Peripheral Nie stosować leku SmofKabiven Peripheral, jeśli u pacjenta występuje:
uczulenie na substancje czynne lub na którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6);
alergia na białko ryb lub jaja;
alergia na orzeszki ziemne lub soję (SmofKabiven Peripheral zawiera olej sojowy);
zbyt wysokie stężenie tłuszczów we krwi (hiperlipidemia);
ciężkie zaburzenia czynności wątroby;
problem z krzepnięciem krwi (zaburzenia krzepnięcia);
wada metabolizmu aminokwasów;
ciężka choroba nerek, bez możliwości przeprowadzenia dializy;
ostry wstrząs;
niekontrolowane, zwiększone stężenie glukozy we krwi (hiperglikemia);
zwiększone stężenie we krwi (surowicy) któregokolwiek z elektrolitów zawartych w leku SmofKabiven Peripheral;
płyn w płucach (ostry obrzęk płuc);
zbyt dużo płynu w organizmie (przewodnienie);
nieleczona niewydolność serca;
zaburzenie w układzie krzepnięcia krwi (zespół hemofagocytarny);
niestabilny stan ogólny, np. ciężki stan pourazowy, niewyrównana cukrzyca, ostry zawał serca, udar, zakrzep, kwasica metaboliczna (zaburzenie polegające na zbyt dużej ilości substancji
o charakterze kwaśnym we krwi), ciężkie zakażenie (ciężka posocznica), śpiączka, niedobór płynów (odwodnienie hipotoniczne).
Nie należy stosować leku SmofKabiven Peripheral u dzieci w wieku poniżej 2 lat.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku SmofKabiven Peripheral należy omówić to z lekarzem, jeśli u pacjenta występuje:
choroba nerek;
cukrzyca;
zapalenie trzustki;
choroba wątroby;
niedoczynność tarczycy (zaburzenia tarczycy);
posocznica (ciężkie zakażenie).
Jeśli podczas infuzji wystąpi gorączka, wysypka, obrzęk, trudności w oddychaniu, dreszcze, pocenie się, nudności lub wymioty, należy niezwłocznie powiadomić o tym fachowy personel medyczny, gdyż objawy te mogą być spowodowane reakcją alergiczną lub podano zbyt dużą dawkę leku.
Lekarz może zalecić regularne badanie krwi w celu oznaczenia prób czynnościowych wątroby i innych wartości.
Dzieci i młodzież
SmofKabiven Peripheral nie jest przeznaczony do podawania noworodkom lub dzieciom w wieku poniżej 2 lat. SmofKabiven Peripheral można podawać dzieciom w wieku od 2 do 16/18 lat.
Smofkabiven Peripheral a inne leki
Należy powiedzieć lekarzowi o wszystkich lekach stosowanych przez pacjenta obecnie lub ostatnio, a także o lekach, które pacjent planuje stosować, również tych, które wydawane są bez recepty.
Ciąża i karmienie piersią
Brak danych dotyczących stosowania leku SmofKabiven Peripheral w okresie ciąży lub podczas karmienia piersią. SmofKabiven Peripheral podaje się kobietom w okresie ciąży lub podczas karmienia piersią jedynie wtedy, gdy lekarz uzna to za konieczne. SmofKabiven Peripheral w okresie ciąży i podczas karmienia piersią może być podawany na zlecenie lekarza.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie dotyczy, ponieważ SmofKabiven Peripheral stosowany jest w szpitalu.
Jak stosować SmofKabiven Peripheral
Możliwe działania niepożądane
Jak przechowywać SmofKabiven Peripheral
Zawartość opakowania i inne informacje Co zawiera SmofKabiven Peripheral Substancjami czynnymi leku są:
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza. W razie wątpliwości należy zwrócić się do lekarza.
Lekarz dobiera indywidualną dawkę w zależności od masy ciała i stanu klinicznego pacjenta. SmofKabiven Peripheral jest podawany tylko przez fachowy personel medyczny.
Zastosowanie większej niż zalecana dawki leku SmofKabiven Peripheral
Jest mało prawdopodobne, aby pacjent otrzymał zbyt dużą dawkę leku SmofKabiven Peripheral, ponieważ lek ten jest podawany przez fachowy personel medyczny.
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Często występujące działania niepożądane (mogą występować nie częściej niż u 1 na 10 pacjentów): nieznaczne podwyższenie temperatury ciała, stan zapalny powierzchownych żył obwodowych w miejscu wkłucia.
Niezbyt często występujące działania niepożądane (mogą występować nie częściej niż u 1 na 100 pacjentów): duże stężenie enzymów wątrobowych we krwi, brak apetytu, nudności, wymioty, dreszcze, zawroty i bóle głowy.
Rzadko występujące działania niepożądane (mogą występować nie częściej niż u 1 na 1000 pacjentów): niskie lub wysokie ciśnienie krwi, trudności w oddychaniu, przyspieszony rytm serca (tachykardia). Reakcje nadwrażliwości (które mogą dawać takie objawy jak obrzęk, gorączka, spadek ciśnienia krwi, wysypka skórna, bąble (wypukłe, czerwone miejsca), zaczerwienienie, ból głowy).
Uczucie gorąca i zimna. Bladość. Lekkie zasinienie ust i skóry (związane z niedotlenieniem krwi). Bóle szyi, pleców, kości, klatki piersiowej i lędźwi.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C, 02-222 Warszawa tel.: +48 22 49 21 301, faks: +48 22 49 21 309
strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie przechowywać w temperaturze powyżej 25°C. Nie zamrażać. Przechowywać w worku zewnętrznym.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na worku i tekturowym pudełku. Termin ważności oznacza ostatni dzień podanego miesiąca.
g na 1000 ml | |
glukoza (jednowodna) alanina | 71 4,4 |
arginina | 3,8 |
glicyna | 3,5 |
histydyna | 0,93 |
izoleucyna | 1,6 |
leucyna | 2,3 |
lizyna (jako octan) | 2,1 |
metionina | 1,3 |
fenyloalanina | 1,6 |
prolina | 3,5 |
seryna | 2,1 |
tauryna | 0,32 |
treonina | 1,4 |
tryptofan | 0,63 |
tyrozyna | 0,12 |
walina | 2,0 |
wapnia chlorek (w postaci związku dwuwodnego) | 0,18 |
sodu glicerofosforan (w postaci związku uwodnionego) | 1,3 |
magnezu siarczan (w postaci związku siedmiowodnego) | 0,38 |
potasu chlorek | 1,4 |
sodu octan (w postaci związku trójwodnego) | 1,1 |
cynku siarczan (w postaci związku siedmiowodnego) | 0,004 |
olej sojowy oczyszczony | 8,5 |
triglicerydy nasyconych kwasów tłuszczowych o średniej długości łańcucha | 8,5 |
olej z oliwek oczyszczony | 7,0 |
olej rybny, bogaty w omega-3 kwasy | 4,2 |
Pozostałe składniki (substancje pomocnicze) to: glicerol, oczyszczone fosfolipidy z jaja kurzego, all-
rac-α-tokoferol, sodu wodorotlenek (do ustalenia pH), sodu oleinian, kwas octowy lodowaty (do ustalenia pH) i woda do wstrzykiwań.
Jak wygląda SmofKabiven Peripheral i co zawiera opakowanie
Roztwory glukozy i aminokwasów są przezroczyste, bezbarwne do lekko żółtych, pozbawione cząstek stałych. Emulsja tłuszczowa jest biała i jednorodna.
Wielkości opakowań:
1 × 1206 ml, 4 × 1206 ml
1 × 1448 ml, 4 × 1448 ml
1 × 1904 ml, 4 × 1904 ml
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca Podmiot odpowiedzialny
Fresenius Kabi AB SE-751 74 Uppsala Szwecja
Wytwórca
Fresenius Kabi Austria GmbH Hafnerstrasse 36
8055 Graz Austria
Fresenius Kabi AB SE-751 74 Uppsala Szwecja
W celu uzyskania bardziej szczegółowych informacji należy zwrócić się do przedstawiciela podmiotu odpowiedzialnego:
Fresenius Kabi Polska Sp. z o.o. Al. Jerozolimskie 134
02-305 Warszawa
tel.: +48 22 345 67 89
Data ostatniej aktualizacji ulotki: 01.06.2023 r.
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Ostrzeżenia i środki ostrożności dotyczące stosowania
W celu uniknięcia zagrożeń związanych z infuzją o szybkości większej niż zalecana, rekomenduje się jej przeprowadzanie w sposób ciągły i odpowiednio kontrolowany, w miarę możliwości z użyciem pompy objętościowej.
Ponieważ wykorzystanie żyły obwodowej do infuzji wiąże się ze zwiększonym ryzykiem zakażenia, podczas zakładania i obsługi cewnika zalecane jest dokładne przestrzeganie zasad postępowania
aseptycznego, aby uniknąć jakiegokolwiek zakażenia.
Zaleca się również kontrolowanie stężenia glukozy i elektrolitów w surowicy, osmolarności oraz bilansu płynów i równowagi kwasowo-zasadowej oraz wykonywanie enzymatycznych prób
wątrobowych.
W przypadku wystąpienia jakichkolwiek oznak lub jakiegokolwiek objawu reakcji anafilaktycznej (takiego jak gorączka, dreszcze, wysypka lub duszność), należy natychmiast przerwać infuzję.
Nie należy podawać leku SmofKabiven Peripheral jednocześnie z krwią w tym samym zestawie infuzyjnym, ze względu na ryzyko wystąpienia pseudoaglutynacji.
W przypadku podawania infuzji do żył obwodowych, istnieje możliwość wystąpienia zakrzepowego zapalenia żył. Codziennie należy sprawdzać czy nie wystąpiły miejscowe oznaki zakrzepowego
zapalenia żył w miejscu wkłucia cewnika.
Sposób podawania
Podanie dożylne, infuzja do żyły obwodowej lub centralnej.
W celu zapewnienia pełnego żywienia pozajelitowego należy dodawać do leku SmofKabiven Peripheral mikroelementy, witaminy i ewentualnie elektrolity (uwzględniając elektrolity będące już w leku SmofKabiven Peripheral), odpowiednio do potrzeb pacjenta.
Dawkowanie
Dorośli pacjenci
Zalecane dawkowanie
Zakres dawki wynosi od 20 do 40 ml leku SmofKabiven Peripheral/kg mc./dobę, co zapewni dostarczenie od 0,6 do 1,3 g aminokwasów/kg mc./dobę (co odpowiada od 0,10 do 0,20 g azotu/kg mc./dobę) i od 14 do 28 kcal/kg mc./dobę energii całkowitej (od 11 do 22 kcal/kg mc./dobę energii pozabiałkowej).
Szybkość infuzji
Maksymalna szybkość infuzji glukozy wynosi 0,25 g/kg mc./godzinę, aminokwasów 0,1 g/kg mc./godzinę, a tłuszczów 0,15 g/kg mc./godzinę.
Szybkość infuzji nie powinna być większa niż 3,0 ml/kg mc./godzinę (co odpowiada 0,10 g
aminokwasów, 0,21 g glukozy i 0,08 g tłuszczów/kg mc./godzinę). Zalecany czas trwania infuzji wynosi od 14 do 24 godzin.
Maksymalna dawka dobowa
Maksymalna dawka dobowa zależy od stanu klinicznego pacjenta i może się zmieniać nawet z dnia na dzień. Zalecana maksymalna dawka dobowa wynosi 40 ml/kg mc./dobę.
Dzieci i młodzież
Dzieci w wieku 2-11 lat
Zalecane dawkowanie
Dawka do 40 ml/kg mc./dobę powinna być regularnie dostosowywana do wymagań pacjenta w wieku dziecięcym, które różnią się znacznie bardziej niż u dorosłych pacjentów.
Szybkość infuzji
Zalecana maksymalna szybkość infuzji wynosi 3,0 ml/ kg mc./godzinę (co odpowiada 0,10 g
aminokwasów/kg mc./godzinę, 0,21 g glukozy/kg mc./godzinę i 0,08 g tłuszczów/kg mc./godzinę). Zalecany czas trwania infuzji wynosi od 12 do 24 godzin.
Poza szczególnymi sytuacjami, w przypadku zastosowania maksymalnej zalecanej dawki dobowej
czas trwania infuzji powinien być nie krótszy niż 13 godzin, zapobiega to przekroczeniu maksymalnej szybkości infuzji.
Maksymalna dawka dobowa
Maksymalna dawka dobowa jest zmienna w zależności od stanu klinicznego pacjenta i może ulegać zmianie nawet z dnia na dzień. Maksymalna zalecana dawka dobowa wynosi 40 ml/kg mc./godzinę.
Młodzież w wieku 12-16/18 lat
U młodzieży SmofKabiven Peripheral można dawkować jak u dorosłych pacjentów.
Specjalne środki ostrożności dotyczące usuwania i przygotowania leku do stosowania
Nie stosować, gdy opakowanie jest uszkodzone.
Stosować wyłącznie wtedy, gdy roztwory aminokwasów i glukozy są przezroczyste, bezbarwne do lekko żółtych, a emulsja tłuszczowa jest biała i jednorodna. Zawartość trzech oddzielnych komór należy zmieszać przed użyciem, a także przed ewentualnym dodaniem innych substancji przez przeznaczony do tego celu port.
Po usunięciu zabezpieczeń należy kilkakrotnie odwracać worek tak, aby dokładnie wymieszać wszystkie składniki leku i otrzymać jednorodną mieszaninę, w której nie mogą być widoczne oznaki rozwarstwienia faz.
Wyłącznie do jednorazowego użycia. Wszelkie niewykorzystane resztki leku pozostałe po infuzji należy zniszczyć.
Zgodność
Dane dotyczące zgodności dostępne są dla leków Dipeptiven, Addamel N/Supliven, Glycophos, Addiphos, Vitalipid N Adult/Infant i Soluvit N w określonych ilościach i w elektrolitach o określonym stężeniu. Podczas dodawania elektrolitów, należy uwzględnić ich ilości już obecne w worku w celu zaspokojenia potrzeb klinicznych pacjenta. Dostępne dane potwierdzają możliwość dodawania ww.
leków do aktywowanego worka zgodnie z poniższą tabelą:
Zakres zgodności: stabilny przez 7 dni, tj. 6 dni przechowywany w temperaturze 2-8C, a następnie 24 godziny w temperaturze 20-25C.
Jednostka | Maksymalna całkowita zawartość | |||
Wielkość worka SmofKabiven Peripheral | ml | 1206 | 1448 | 1904 |
Dodatek | Objętość | |||
Dipeptiven | ml | 0 - 300 | 0 - 300 | 0 - 300 |
Supliven/Addamel N | ml | 0 - 10 | 0 - 10 | 0 - 10 |
Soluvit N | fiolka | 0 - 1 | 0 - 1 | 0 - 1 |
Vitalipid N Adult/Infant | ml | 0 - 10 | 0 - 10 | 0 - 10 |
Limity elektrolitów1 | Ilość na worek | |||
Sód | mmol | ≤ 180 | ≤ 225 | ≤ 300 |
Potas | mmol | ≤ 180 | ≤ 225 | ≤ 300 |
Wapń | mmol | ≤ 6 | ≤ 7,5 | ≤ 10 |
Magnez | mmol | ≤ 6 | ≤ 7,5 | ≤ 10 |
Fosforan nieorganiczny (Addiphos) lub Fosforan organiczny (Glycophos) | mmol | ≤ 18 | ≤ 22,5 | ≤ 30 |
Cynk | mmol | ≤ 0,2 | ≤ 0,25 | ≤ 0,3 |
Selen | µmol | ≤ 1 | ≤ 1 | ≤ 1 |
1 Obejmuje ilości pochodzące ze wszystkich produktów.
Uwaga: tabela ta ma na celu wykazanie zgodności. Nie stanowi ona wytycznych dotyczących dawkowania. Przed przepisaniem ww. leków należy zapoznać się z zatwierdzonymi drukami informacyjnymi.
Informacje na temat zgodności z innymi dodatkami oraz czasów przechowywania różnych mieszanin będą dostępne na życzenie.
Wszelkie dodatki należy łączyć z lekiem w warunkach aseptycznych.
Okres ważności po zmieszaniu zawartości komór worka
Wykazano stabilność fizyczną i chemiczną zmieszanej zawartości worka trójkomorowego przez 48 godzin w temperaturze 20-25C. Z mikrobiologicznego punktu widzenia lek należy zużyć natychmiast. W przeciwnym razie, za okres przechowywania podczas użytkowania i za warunki przechowywania przed zastosowaniem odpowiada użytkownik. Okres ten nie powinien zasadniczo
przekraczać 24 godzin w temperaturze 2-8C, chyba że mieszanie miało miejsce w kontrolowanych i zwalidowanych warunkach aseptycznych.
Okres ważności po zmieszaniu z dodatkowymi substancjami
Wykazano stabilność fizyko-chemiczną zmieszanej zawartości worka trójkomorowego
z dodatkowymi substancjami przez okres do 7 dni tj. 6 dni w temperaturze 2-8C, a następnie
24 godziny w temperaturze 20-25C, włączając czas trwania infuzji. Z mikrobiologicznego punktu widzenia lek należy zużyć natychmiast po dodaniu innych składników. W przeciwnym razie, za okres przechowywania podczas użytkowania i za warunki przechowywania przed zastosowaniem
odpowiada użytkownik. Okres ten nie powinien zasadniczo przekraczać 24 godzin w temperaturze 2-8C, chyba że mieszanie miało miejsce w kontrolowanych i zwalidowanych warunkach aseptycznych.
SmofKabiven Peripheral Instrukcja przygotowania worka do użycia
Usuwanie worka zewnętrznego
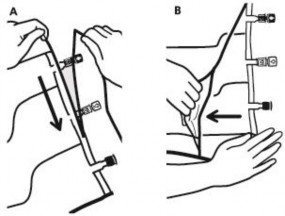
Aby usunąć worek zewnętrzny, należy ułożyć go poziomo i zaczynając od nacięcia znajdującego się blisko portów rozrywać wzdłuż górnego brzegu (A).
Następnie rozerwać worek zewnętrzny wzdłuż długiego brzegu, zdjąć go i wyrzucić razem z pochłaniaczem tlenu (B).
Mieszanie
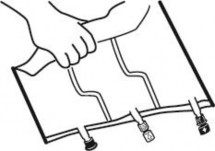
Ułożyć worek na płaskiej powierzchni.
Zaczynając od strony uchwytu mocno zrolować worek w kierunku portów, najpierw prawą
ręką, a następnie wywierając stały ucisk lewą, aż do pęknięcia zgrzewów pionowych. Otwierają się one pod działaniem ciśnienia płynu. Zgrzewy można również otworzyć przed usunięciem worka zewnętrznego.
Uwaga: płyn miesza się łatwo, mimo że zgrzew poziomy pozostaje nienaruszony.
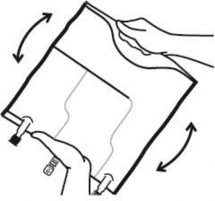
Wymieszać zawartość trzech komór odwracając trzykrotnie worek, co powinno zapewnić dokładne wymieszanie składników.
Końcowe czynności przygotowawcze
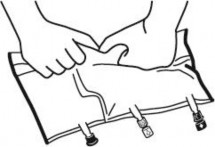
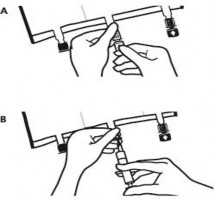
Ponownie umieścić worek na płaskiej, równej powierzchni. Tuż przed podaniem dodatkowych substancji oderwać oznakowaną strzałką zatyczkę jednorazowego użytku zabezpieczającą biały port do podawania dodatkowych substancji (A).
Uwaga: membrana portu służącego do podawania dodatkowych substancji jest jałowa.
Przytrzymać podstawę portu służącego do podawania dodatkowych substancji. Wprowadzić igłę, wstrzyknąć dodatkowe substancje (o znanej zgodności) przez środek miejsca do wstrzykiwań (B).
Wymieszać dokładnie zawartość worka po dodaniu każdego składnika obracając trzykrotnie worek po każdym dodaniu. Stosować strzykawki z igłami o średnicy 18 do 23 G i o długości maksymalnej 40 mm.
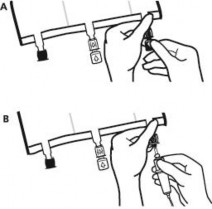
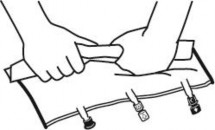
Tuż przed podłączeniem zestawu do infuzji oderwać zatyczkę jednorazowego użytku zabezpieczającą niebieski port infuzyjny (A).
Uwaga: membrana portu infuzyjnego jest jałowa.
Stosować zestawy infuzyjne bez odpowietrznika lub zamknąć odpowietrznik.
Przytrzymać podstawę portu infuzyjnego.
Wprowadzić kolec zestawu do infuzji w port infuzyjny. Aby zapewnić dobre umocowanie kolca, należy wkłuć całą jego długość.
Uwaga: Wewnętrzna powierzchnia portu infuzyjnego jest jałowa.
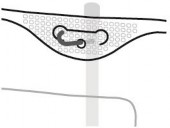
Zawieszanie worka
Zawiesić worek wykorzystując otwór znajdujący się poniżej uchwytu.











