Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
HeliPico, 27,78 mg/5 ml, syrop
100 ml syropu zawiera 555,6 mg wyciągu (jako wyciąg suchy) z Hedera helix L., folium (liść
bluszczu) (4-8:1). Rozpuszczalnik ekstrakcyjny: etanol 30% (m/m). 5 ml syropu zawiera 27,78 mg wyciągu suchego z liści bluszczu.
Substancje pomocnicze o znanym działaniu:
Każde 5 ml syropu zawiera 4200 mg sorbitolu ciekłego niekrystalizującego, co odpowiada 3024 mg sorbitolu (E420), 150,6 mg glikolu propylenowego (E1520), 25 mg makrogologlicerolu hydroksystearynianu, 0,7 mg etanolu oraz olejek anyżowy.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Syrop
Produkt leczniczy roślinny stosowany jako środek wykrztuśny w przypadku produktywnego
(mokrego) kaszlu.
Dawkowanie
Młodzież w wieku od 12 lat, dorośli i pacjenci w podeszłym wieku: od 2 do 3 razy na dobę po 5 ml (pełna strzykawka doustna), co odpowiada dawce dobowej od 55,56 mg do 83,34 mg suchego wyciągu.
Dzieci w wieku od 6 do 11 lat: 3 razy na dobę po 2,5 ml (½ strzykawki doustnej), co odpowiada dawce dobowej 41,67 mg suchego wyciągu.
Dzieci w wieku od 2 do 5 lat: 3 razy na dobę po 1,6 ml (⅓ strzykawki doustnej), co odpowiada dawce dobowej 26,67 mg suchego wyciągu.
Dzieci w wieku poniżej 2 lat
Stosowanie u dzieci w wieku poniżej 2 lat jest przeciwwskazane (patrz punkt 4.3).
Czas stosowania
Jeśli objawy utrzymują się dłużej niż jeden tydzień podczas stosowania produktu leczniczego należy skonsultować się z lekarzem.
Sposób podawania Podanie doustne.
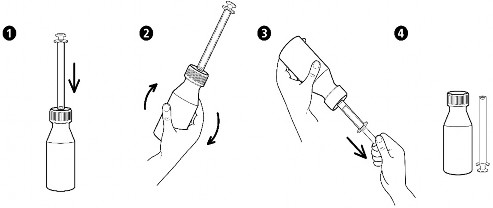
Instrukcja użytkowania dozownika w formie strzykawki
Nadwrażliwość na substancję czynną, na inne rośliny z rodziny araliowatych (Araliaceae) lub rośliny z rodziny selerowatych (Apiaceae, dawniej Umbelliferae) jak anyż, kminek, seler, kolendra, koper ogrodowy, lub na anetol, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Nie stosować u dzieci w wieku poniżej 2 lat ze względu na ryzyko pogorszenia się objawów ze strony
układu oddechowego.
Utrzymujący się lub nawracający kaszel u dzieci w wieku od 2 do 4 lat wymaga diagnozy lekarskiej
przed rozpoczęciem terapii.
W przypadku wystąpienia objawów duszności, gorączki lub ropnej plwociny należy skonsultować się
z lekarzem lub farmaceutą.
Nie zaleca się jednoczesnego stosowania opioidowych leków przeciwkaszlowych, takich jak: kodeina lub dekstrometorfan, bez konsultacji z lekarzem.
Zalecana się ostrożność w przypadku stosowania u pacjentów z zapaleniem błony śluzowej żołądka lub wrzodem żołądka.
Wskazówki dla diabetyków
Syrop HeliPico nie zawiera cukru, może być stosowany przez diabetyków.
Produkt zawiera zawiera 4200 mg sorbitolu ciekłego niekrystalizującego, co odpowiada 3024 mg sorbitolu (E420) w 5 każdych 5 ml syropu i jest równoważne 0,252 jednostkom chlebowym. Pacjenci z dziedziczną nietolerancją fruktozy nie mogą przyjmować tego produktu leczniczego.
Sorbitol może powodować dyskomfort ze strony układu pokarmowego i może mieć łagodne działanie przeczyszczające.
Produkt zawiera 150,6 mg glikolu propylenowego (E1520) w każdych 5 ml syropu.
Produkt zawiera makrogologlicerolu hydroksystearynian, może powodować niestrawność i biegunkę.
Ten produkt zawiera 0,7 mg alkoholu w 5 ml syropu. Ilość alkoholu w każdych 5 ml tego produktu odpowiada mniej niż 1 ml piwa lub mniej niż 1 ml wina. Mała ilość alkoholu w tym produkcie nie będzie powodowała zauważalnych skutkow.
Nie zgłoszono.
Bezpieczeństwo stosowania produktu w okresie ciąży i karmienia piersią nie zostało ustalone. Ze względu na brak wystarczających danych, stosowanie w czasie ciąży i karmienia piersią nie jest zalecane.
Brak danych dotyczących wpływu na płodność.
Nie przeprowadzono badań na temat wpływu na zdolność prowadzenia pojazdów i obsługiwania
maszyn.
Działania niepożądane uszeregowano według układów i narządów, zgodnie z terminologią MedDRA. Bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do <1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), nieznana (częstość nie może być określona na podstawie dostępnych danych).
Zaburzenia układu immunologicznego
Częstość nieznana: reakcje alergiczne (pokrzywka, wysypka skórna, duszność).
Zaburzenia żołądka i jelit
Częstość nieznana: nudności, wymioty, biegunka.
W przypadku wystąpienia działań niepożądanych niewymienionych powyżej, należy skonsultować się z lekarzem lub farmaceutą.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie może wywołać nudności, wymioty, biegunkę i pobudzenie ruchowe. Odnotowano jeden przypadek 4-letniego dziecka, u którego wystąpiły objawy agresji i biegunka po przypadkowym spożyciu wyciągu bluszczu odpowiadającym 1,8 g surowca roślinnego.
Sposób postępowania po przedawkowaniu:
W przypadku przedawkowania należy stosować leczenie objawowe.
Grupa farmakoterapeutyczna: leki stosowane w kaszlu i przeziębieniu; leki wykrztuśne, kod ATC: R05CA12
Mechanizm działania jest nieznany.
Brak danych.
Suchy wyciąg z liści bluszczu nie wykazywał właściwości mutagennych w teście Amesa.
Brak danych dla preparatów z liści bluszczu na temat rakotwórczości i toksycznego wpływu na reprodukcję.
Glikol propylenowy
Sorbitol ciekły niekrystalizujący (E420) Makrogologlicerolu hydroksystearynian Sorbinian potasu (E202)
Kwas cytrynowy jednowodny
Guma ksantan
Aromat anyżowy (etanol, glikol propylenowy, propanol, olejek anyżowy naturalny) Woda oczyszczona
Nie dotyczy.
2 lata
Okres ważności produktu po pierwszym otwarciu butelki wynosi 6 miesięcy.
Nie przechowywać w temperaturze powyżej 25°C.
Przechowywać w oryginalnym opakowaniu. Przechowywać butelkę szczelnie zamkniętą.
Butelka PET brązowa z adapterem z polietylenu z zakrętką polietylenową z HDPE, z pierścieniem gwarancyjnym, z systemem zabezpieczającym przed otwarciem przez dziecko wraz z dozownikiem w formie strzykawki doustnej w tekturowym pudełku.
Nieznaczne zmętnienie syropu i wytrącający się osad są spowodowane obecnością w nim składników roślinnych. Stan ten nie ma wpływu na działanie produktu.
1 butelka 100 ml
Bez specjalnych wymagań.
DOPUSZCZENIE DO OBROTU
Zakłady Farmaceutyczne POLPHARMA S.A.
ul. Pelplińska 19, 83-200 Starogard Gdański
Pozwolenie nr 10044
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 23.10.2003 r.
Data ostatniego przedłużenia pozwolenia: 05.09.2013 r.











