Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
nadwrażliwość na substancje czynne, białko jaj, ryb, orzechów ziemnych lub soi, lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1;
wrodzone zaburzenia metabolizmu aminokwasów;
ciężka hiperlipidemia przejawiająca się hipertriglicerydemią (≥ 1000 mg/dl lub 11,4 mmol/l);
ciężka koagulopatia;
hiperglikemia nie reagująca na dawki insuliny do 6 jednostek na godzinę;
kwasica;
cholestaza wewnątrzwątrobowa;
ciężka niewydolność wątroby;
ciężka niewydolność nerek przy braku terapii nerkozastępczej;
narastające skazy krwotoczne;
ostre zdarzenia zakrzepowo-zatorowe, zator tłuszczowy.
Ze względu na skład produkt Omegaflex special bez elektrolitów nie może być stosowany u noworodków, niemowląt i małych dzieci poniżej 2 lat.
Ogólne przeciwwskazania do żywienia pozajelitowego obejmują:
niestabilny stan krążeniowy z zagrożeniem życia (stany zapaści i wstrząsu);
ostre fazy zawału mięśnia sercowego i udaru;
niestabilny metabolizm (np. ciężki zespół powstrząsowy, śpiączka nieznanego pochodzenia);
niedostateczne zaopatrzenie komórek w tlen;
zaburzenia równowagi elektrolitów i płynów;
ostry obrzęk płuc;
niewyrównana niewydolność serca.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
625 ml (250 ml roztworu aminokwasów + 125 ml emulsji tłuszczowej + 250 ml roztworu glukozy)
1250 ml (500 ml roztworu aminokwasów + 250 ml emulsji tłuszczowej + 500 ml roztworu glukozy)
1875 ml (750 ml roztworu aminokwasów + 375 ml emulsji tłuszczowej + 750 ml roztworu glukozy)
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Elektrolity: w mieszaninie trójskładnikowej wykazano stabilność do całkowitej ilości 200 mmol/l sodu + potasu (łącznie), 9,6 mmol/l magnezu i 6,4 mmol/l wapnia.
Fosforan: wykazano stabilność do maksymalnego stężenia 20 mmol/l fosforanu nieorganicznego lub do maksymalnego stężenia 30 mmol/l fosforanu organicznego (nie obydwa jednocześnie).
Alanylo-glutamina do 24 g/l.
Pierwiastki śladowe i witaminy: wykazano stabilność przy użyciu dostępnych na rynku produktów zawierających dużą liczbę pierwiastków śladowych i witamin (np. Tracutil, Cernevit) do standardowej dawki zalecanej przez odpowiedniego producenta preparatu mikroelementów.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Omegaflex special bez elektrolitów, emulsja do infuzji
Gotowa do użycia emulsja to infuzji dożylnej po wymieszaniu komór zawiera następujące składniki:
z komory górnej (roztwór glukozy) | w 1000 ml | w 625 ml | w 1250 ml | w 1875 ml |
Glukoza jednowodna | 158,4 g | 99,00 g | 198,0 g | 297,0 g |
zawartość równ. glukozy | 144,0 g | 90,00 g | 180,0 g | 270,0 g |
z komory pośredniej (emulsja tłuszczowa) | w 1000 ml | w 625 ml | w 1250 ml | w 1875 ml |
Triglicerydy nasyconych kwasów tłuszczowych o średniej długości łańcucha | 20,00 g | 12,50 g | 25,00 g | 37,50 g |
Olej sojowy oczyszczony | 16,00 g | 10,00 g | 20,00 g | 30,00 g |
Omega-3 kwasów triglicerydy | 4,000 g | 2,500 g | 5,000 g | 7,500 g |
z komory dolnej (roztwór aminokwasów) | w 1000 ml | w 625 ml | w 1250 ml | w 1875 ml |
Izoleucyna | 3,284 g | 2,053 g | 4,105 g | 6,158 g |
Leucyna | 4,384 g | 2,740 g | 5,480 g | 8,220 g |
Lizyna jednowodna | 3,576 g | 2,235 g | 4,470 g | 6,705 g |
co odpowiada zawartości lizyny | 3,184 g | 1,990 g | 3,979 g | 5,969 g |
Metionina | 2,736 g | 1,710 g | 3,420 g | 5,130 g |
Fenyloalanina | 4,916 g | 3,073 g | 6,145 g | 9,218 g |
Treonina | 2,540 g | 1,588 g | 3,175 g | 4,763 g |
Tryptofan | 0,800 g | 0,500 g | 1,000 g | 1,500 g |
Walina | 3,604 g | 2,253 g | 4,505 g | 6,758 g |
Arginina | 3,780 g | 2,363 g | 4,725 g | 7,088 g |
Histydyna | 1,752 g | 1,095 g | 2,190 g | 3,285 g |
Alanina | 6,792 g | 4,245 g | 8,490 g | 12,73 g |
Kwas asparaginowy | 2,100 g | 1,313 g | 2,625 g | 3,938 g |
Kwas glutaminowy | 4,908 g | 3,068 g | 6,135 g | 9,203 g |
Glicyna | 2,312 g | 1,445 g | 2,890 g | 4,335 g |
Prolina | 4,760 g | 2,975 g | 5,950 g | 8,925 g |
Seryna | 4,200 g | 2,625 g | 5,250 g | 7,875 g |
w 1000 ml | w 625 ml | w 1250 ml | w 1875 ml | |
Zawartość aminokwasów [g] | 56,0 | 35,0 | 70,1 | 105,1 |
Zawartość azotu [g] | 8 | 5 | 10 | 15 |
Zawartość węglowodanów [g] | 144 | 90 | 180 | 270 |
Zawartość tłuszczów [g] | 40 | 25 | 50 | 75 |
Substancja pomocnicza o znanym działaniu
Sód (pochodzący z sodu oleinianu i sodu wodorotlenku) - maksymalnie 0,5 mmol/w gotowej do użycia emulsji.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Emulsja do infuzji
Roztwory aminokwasów i glukozy: roztwory przezroczyste, bezbarwne do słomkowych. Emulsja tłuszczu: mlecznobiała emulsja typu olej w wodzie
w 1000 ml | w 625 ml | w 1250 ml | w 1875 ml | |
Wartość kaloryczna w postaci tłuszczów [kJ (kcal)] | 1590 (380) | 995 (240) | 1990 (475) | 2985 (715) |
Wartość kaloryczna w postaci węglowodanów [kJ (kcal)] | 2415 (575) | 1510 (360) | 3015 (720) | 4520 (1080) |
Wartość kaloryczna w postaci aminokwasów [kJ (kcal)] | 940 (225) | 585 (140) | 1170 (280) | 1755 (420) |
Wartość kaloryczna ze źródeł innych niż białka [kJ (kcal)] | 4005 (955) | 2505 (600) | 5005 (1195) | 7510 (1795) |
Całkowita wartość kaloryczna [kJ (kcal)] | 4945 (1180) | 3090 (740) | 6175 (1475) | 9265 (2215) |
Osmolalność [mOsm/kg] | 1840 |
Osmolarność teoretyczna [mOsm/l] | 1330 |
pH | 5,0–6,0 |
Dostarczanie energii, niezbędnych kwasów tłuszczowych, w tym kwasów omega-3 i omega-6, aminokwasów i płynów do żywienia pozajelitowego w stanach umiarkowanego do ciężkiego katabolizmu, gdy odżywianie doustne jest niemożliwe, niewystarczające lub niewskazane.
Produkt leczniczy Omegaflex special bez elektrolitów jest wskazany do stosowania u dorosłych.
Dawkowanie
Dawkowanie należy dostosować do indywidualnych wymagań pacjenta.
Zaleca się, by produkt Omegaflex special bez elektrolitów był podawany w sposób ciągły. Stopniowe zwiększanie szybkości infuzji w ciągu pierwszych 30 minut do żądanej szybkości infuzji pozwala uniknąć możliwych powikłań.
Dorośli
Maksymalna dawka dzienna wynosi 35 ml/kg masy ciała, co odpowiada 2,0 g aminokwasów /kg masy ciała na dobę
5,04 g glukozy /kg masy ciała na dobę
1,4 g tłuszczów /kg masy ciała na dobę
Maksymalna szybkość infuzji wynosi 1,7 ml/kg masy ciała na godzinę, co odpowiada 0,1 g aminokwasów /kg masy ciała na godzinę
0,24 g glukozy /kg masy ciała na godzinę 0,07 g tłuszczów /kg masy ciała na godzinę
W przypadku pacjenta o masie 70 kg odpowiada to maksymalnej szybkości infuzji wynoszącej 119 ml na godzinę. Ilość substratu podanego w takich warunkach wynosi 6,8 g aminokwasów na godzinę, 17,1 g glukozy na godzinę i 4,8 g tłuszczów na godzinę.
Dzieci i młodzież
Omegaflex special bez elektrolitów jest przeciwwskazany u noworodków, niemowląt i małych dzieci w wieku poniżej dwóch lat (patrz punkt 4.3).
Nie określono dotychczas bezpieczeństwa stosowania i skuteczności produktu leczniczego u dzieci i młodzieży w wieku > 2 lat. Dane nie są dostępne.
Pacjenci z zaburzeniami czynności nerek/wątroby
U pacjentów z niewydolnością wątroby lub nerek dawki należy dostosować indywidualnie (patrz punkt 4.4).
Czas trwania leczenia
Brak ograniczeń czasu trwania leczenia dla podanych wskazań. Podczas podawania produktu Omegaflex special bez elektrolitów konieczne jest dostarczenie odpowiednich ilości elektrolitów, pierwiastków śladowych i witamin.
Czas trwania infuzji z jednego worka
Zalecany czas trwania infuzji dla pojedynczego worka z emulsją do żywienia pozajelitowego wynosi maksymalnie 24 godziny.
Sposób podawania
Podanie dożylne. Wyłącznie infuzja do żyły centralnej.
Należy zachować ostrożność w przypadku podwyższonej osmolarności surowicy.
Przed rozpoczęciem infuzji należy wyrównać zaburzenia równowagi płynów, elektrolitów lub kwasowo-zasadowej.
Zbyt szybka infuzja może prowadzić do przeciążenia płynami z patologicznymi stężeniami elektrolitów w surowicy, nadmiernego nawodnienia i obrzęku płuc.
W przypadku stwierdzenia jakichkolwiek objawów reakcji anafilaktycznej (takich jak gorączka, dreszcze, wysypka lub duszność) należy natychmiast przerwać infuzję.
Konieczne jest kontrolowanie stężenia elektrolitów w surowicy, równowagi wodnej, równowagi kwasowo-zasadowej i morfologii krwi, stanu krzepnięcia oraz czynności wątroby i nerek.
Produkt Omegaflex special bez elektrolitów praktycznie nie zawiera elektrolitów, dlatego zalecany jest szczególnie dla pacjentów o zmniejszonym i/lub nietypowym zapotrzebowaniu na elektrolity. Sód, potas, wapń, magnez i fosforan powinny być zastępowane zgodnie ze szczegółowymi zaleceniami opartymi na ocenie klinicznej. Konieczne jest stałe monitorowanie stężenia elektrolitów.
Ponowne odżywienie lub nasycenie niedożywionych lub wyczerpanych pacjentów może prowadzić do hipokalemii, hipopotasemii i hipomagnezemii. Konieczne jest stałe monitorowanie stężenia
elektrolitów w surowicy. Konieczne jest odpowiednie uzupełnianie elektrolitów, zgodnie z odchyleniami od wartości prawidłowych.
Przy infuzji produktu Omegaflex special bez elektrolitów należy monitorować stężenie triglicerydów w surowicy.
W zależności od stanu metabolicznego pacjenta możliwe jest okazjonalne wystąpienie
hipertriglicerydemii. Jeśli podczas podawania tłuszczów stężenie triglicerydów w osoczu przekroczy 4,6 mmol/l (400 mg/dl), zaleca się zmniejszenie szybkości infuzji. Infuzję należy przerwać, jeśli
stężenie triglicerydów w osoczu przekroczy 11,4 mmol/l (1000 mg/dl), ponieważ stężenia te zostały powiązane z ostrym zapaleniem trzustki.
Pacjenci z zaburzeniami metabolizmu tłuszczów
Należy zachować ostrożność przy podawaniu produktu Omegaflex special bez elektrolitów pacjentom z zaburzeniami metabolizmu tłuszczów o podwyższonym stężeniu triglicerydów w surowicy, np.
niewydolnością nerek, cukrzycą, zapaleniem trzustki, zaburzeniami czynności wątroby,
niedoczynnością tarczycy (z hipertriglicerydemią), posocznicą i zespołem metabolicznym. W przypadku podawania produktu Omegaflex special bez elektrolitów pacjentom z tymi chorobami, konieczne jest częstsze monitorowanie stężenia triglicerydów w surowicy w celu zapewnienia
eliminacji triglicerydów i stabilnego stężenia triglicerydów poniżej 11,4 mmol/l (1000 mg/dl).
W hiperlipidemiach złożonych i zespole metabolicznym stężenia triglicerydów reagują na stężenia glukozy, tłuszczów i nadmierną podaż substancji odżywczych. Należy odpowiednio dostosować dawkę. Należy ocenić i monitorować inne źródła tłuszczów i glukozy oraz leków wpływających na ich metabolizm.
Obecność hipertriglicerydemii 12 godzin po podaniu tłuszczów również wskazuje na zaburzenie metabolizmu tłuszczów.
Podobnie jak w przypadku wszystkich roztworów zawierających węglowodany, podawanie produktu Omegaflex special bez elektrolitów może prowadzić do hiperglikemii. Należy monitorować stężenie glukozy we krwi. W przypadku występowania hiperglikemii należy zmniejszyć szybkość infuzji lub podać insulinę. Jeśli pacjent równocześnie otrzymuje dożylnie inne roztwory glukozy, należy
uwzględnić ilość dodatkowo podawanej glukozy.
Przerwanie podawania emulsji może być w wskazane, jeśli stężenie glukozy we krwi podczas podawania wzrośnie powyżej 14 mmol/l (250 mg/dl).
Pierwiastki śladowe i witaminy powinny być uzupełniane zgodnie z zaleceniami żywieniowymi i klinicznymi.
Omegaflex special bez elektrolitów jest preparatem o złożonym składzie. W związku z tym zdecydowanie zaleca się niedodawanie innych roztworów (jeśli nie dowiedziono zgodności – patrz punkt 6.2).
Podobnie jak w przypadku wszystkich roztworów dożylnych, szczególnie do żywienia pozajelitowego, przy infuzji produktu Omegaflex special bez elektrolitów konieczne jest ścisłe przestrzeganie zasad aseptyki.
Dzieci i młodzież
Nie odnotowano dotychczas przypadków klinicznego stosowania Omegaflex special bez elektrolitów u dzieci i młodzieży.
Pacjenci w podeszłym wieku
Zasadniczo stosuje się takie samo dawkowanie jak dla dorosłych, jednak należy zachować ostrożność u pacjentów cierpiących na inne choroby, takie jak niewydolność serca lub niewydolność nerek, które mogą często występować w podeszłym wieku.
Pacjenci z cukrzycą, zaburzeniami czynności serca lub nerek
Podobnie jak w przypadku wszystkich roztworów do infuzji o dużej objętości, produkt Omegaflex special bez elektrolitów należy podawać ostrożnie pacjentom z zaburzeniami czynności serca lub nerek.
Dostępne są tylko ograniczone dane dotyczące stosowania produktu u pacjentów z cukrzycą lub niewydolnością nerek.
U pacjentów cierpiących na niewydolność nerek konieczne jest stałe kontrolowanie stężenia fosforanu z uwagi na niebezpieczeństwo wystąpienia hiperfosfatemii. Jednocześnie zaś, u pacjentów poddawanych ciągłemu leczeniu nerkozastępczemu konieczne jest regularne monitorowanie i odpowiednie zastępowanie fosforanu w celu zapobiegania hipofosfatemii.
Specjalne ostrzeżenia i środki ostrożności dotyczące substancji pomocniczych
Produkt leczniczy zawiera poniżej 1 mmol sodu (23 mg) na worek wielokomorowy, tym samym jest praktycznie wolny od zawartości sodu.
Wpływ na wyniki badań laboratoryjnych
Zawartość tłuszczu może wpłynąć na pewne pomiary laboratoryjne (np. stężenie bilirubiny, dehydrogenazy mleczanowej, wysycenia tlenem), jeśli krew zostanie pobrana zanim tłuszcz zostanie odpowiednio usunięty z krążenia.
Niektóre leki, takie jak insulina, mogą wpływać na system lipazy organizmu. Jednakże tego typu interakcje wydają się mieć tylko ograniczone znaczenie kliniczne.
Heparyna podawana w dawkach klinicznych powoduje przejściowe uwolnienie lipazy lipoproteinowej do krążenia. Może to początkowo prowadzić do zwiększonej lipolizy w osoczu, po której następuje przejściowe zmniejszenie klirensu triglicerydów.
Olej sojowy zawiera również naturalną witaminę K1. Może to wpływać na działanie terapeutyczne pochodnych kumaryny, które należy ściśle monitorować u pacjentów leczonych takimi lekami.
Ze względu na ryzyko pseudoaglutynacji produktu Omegaflex special bez elektrolitów nie należy podawać jednocześnie z krwią w tym samym zestawie do infuzji.
Ciąża
Brak danych lub istnieją tylko ograniczone dane dotyczące stosowania produktu Omegaflex special bez elektrolitów u kobiet w okresie ciąży. Badania na zwierzętach są niewystarczające w zakresie danych dotyczących toksyczności reprodukcyjnej (patrz punkt 5.3).
Żywienie pozajelitowe może się stać konieczne podczas ciąży. Omegaflex special bez elektrolitów powinien być podawany kobietom w ciąży jedynie po starannym rozważeniu.
Karmienie piersią
Składniki/metabolity produktu Omegaflex special bez elektrolitów przenikają do mleka ludzkiego, ale przy dawkach terapeutycznych nie należy się spodziewać wpływu na organizm noworodków/dzieci karmionych piersią. Pomimo tego, karmienie piersią nie jest zalecane dla matek otrzymujących
żywienie pozajelitowe.
Płodność
Brak jest danych dotyczących stosowania produktu Omegaflex special bez elektrolitów.
Omegaflex special bez elektrolitów nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Nawet w warunkach prawidłowego stosowania w zakresie monitorowania dawki, przestrzegania ograniczeń dotyczących bezpieczeństwa oraz instrukcji, mogą wystąpić działania niepożądane. Poniższa lista obejmuje reakcje ogólnoustrojowe, które mogą być powiązane ze stosowaniem produktu leczniczego Omegaflex special bez elektrolitów.
Działania niepożądane wymieniono na podstawie częstości występowania: | |
Bardzo często | ( 1/10) |
Często | (≥ 1/100 do < 1/10) |
Niezbyt często | (≥ 1/1000 do < 1/100) |
Rzadko | ( 1/10 000 do <1/1000) |
Bardzo rzadko | (< 1/10 000) |
Nie znana | (częstość nie może być określona na podstawie dostępnych danych) |
Zaburzenia krwi i układu chłonnego
Rzadko: nadkrzepliwość
Nie znana: leukopenia, trombocytopenia
Zaburzenia układu immunologicznego
Rzadko: reakcje alergiczne (np. reakcje anafilaktyczne, wykwity skórne, obrzęk gardła, ust i twarzy)
Zaburzenia metabolizmu i odżywiania
Bardzo rzadko: hiperlipidemia, hiperglikemia, kwasica metaboliczna
Częstość występowania tych działań niepożądanych zależy od dawki i może być wyższa w warunkach bezwzględnego lub względnego przedawkowania tłuszczów.
Zaburzenia układu nerwowego
Rzadko: ból głowy, senność
Zaburzenia naczyniowe
Rzadko: nadciśnienie lub niedociśnienie, zaczerwienienie
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia
Rzadko: duszność, sinica
Zaburzenia żołądka i jelit
Niezbyt często: nudności, wymioty.
Zaburzenia metabolizmu i odżywiania
Niezbyt często: utrata apetytu.
Zaburzenia wątroby i dróg żółciowych
Nie znana: cholestaza
Zaburzenia skóry i tkanki podskórnej
Rzadko: rumień, pocenie się
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej
Rzadko: ból w plecach, kościach, klatce piersiowej lub okolicy lędźwiowej
Zaburzenia ogólne i stany w miejscu podania
Rzadko: podwyższona temperatura, uczucie zimna, dreszcze Bardzo rzadko: zespół przeciążenia tłuszczami (patrz szczegóły poniżej)
W przypadku wystąpienia działań niepożądanych należy natychmiast przerwać infuzję.
W razie wzrostu stężenia triglicerydów podczas infuzji powyżej 11,4 mmol/l (1000 mg/dl), należy ją przerwać. Przy stężeniach powyżej 4,6 mmol/l (400 mg/dl) infuzję można kontynuować przy dawce zmniejszonym dawkowaniu (patrz punkt 4.4).
Po wznowieniu infuzji pacjenta należy uważnie monitorować, szczególnie na początku, i w krótkich odstępach oznaczać stężenie triglicerydów w osoczu.
Informacje dotyczące poszczególnych działań niepożądanych
Nudności, wymioty i brak apetytu to objawy często związane ze stanami, w których wskazane jest żywienie pozajelitowe i może być równocześnie powiązane z żywieniem pozajelitowym.
Zespół przeciążenia tłuszczem
Zaburzona zdolność do eliminacji triglicerydów może prowadzić do zespołu przeciążenia tłuszczem, który może być skutkiem przedawkowania. Należy obserwować możliwe oznaki przeciążenia
metabolicznego. Przyczyna może być genetyczna (indywidualne różnice metabolizmu) lub też
metabolizm tłuszczów może być zmieniony pod wpływem trwającej lub przebytej choroby. Zespół ten może pojawić się podczas ciężkiej hipertriglicerydemii, nawet przy zalecanej szybkości infuzji oraz w skojarzeniu z nagłą zmianą w stanie klinicznym pacjenta, taką jak zaburzenie czynności nerek lub
zakażenie. Zespół przeciążenia tłuszczem charakteryzuje się hiperlipidemią, gorączką, naciekami tłuszczowymi, hepatomegalią z żółtaczką lub bez, splenomegalią, niedokrwistością, leukopenią, małopłytkowością, zaburzeniami krzepnięcia krwi, hemolizą i retykulocytozą, nieprawidłowymi
wynikami testów wątrobowych i śpiączką. Objawy te są zazwyczaj odwracalne po przerwania infuzji emulsji tłuszczowej.
W przypadku wystąpienia objawów przeciążenia tłuszczem należy natychmiast przerwać infuzję produktu Omegaflex special bez elektrolitów.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu
medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49-21-301, fax: +48 22 49-21- 309, Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy przedawkowania płynów
Przewodnienie, zaburzenia równowagi elektrolitowej i obrzęk płuc
Objawy przedawkowania aminokwasów
Utrata aminokwasów przez nerki prowadząca do zaburzenia równowagi aminokwasów, nudności, wymioty i dreszcze
Objawy przedawkowania glukozy
Hiperglikemia, cukromocz, odwodnienie, hiperosmolalność, śpiączka hiperglikemiczna i hiperosmotyczna
Objawy przedawkowania tłuszczów
Patrz punkt 4.8.
Leczenie
W przypadku przedawkowania wskazane jest natychmiastowe zaprzestanie infuzji. Dalsze działania terapeutyczne zależne są od poszczególnych objawów oraz ich nasilenia. Po wznowieniu infuzji po ustąpieniu objawów zaleca się stopniowe zwiększanie szybkości infuzji oraz częste monitorowanie pacjenta.
5.1. Właściwości farmakodynamiczne
Grupa farmakoterapeutyczna: roztwory do żywienia pozajelitowego, mieszaniny kod ATC: B 05BA10
Mechanizm działania
Celem żywienia pozajelitowego jest dostarczenie wszystkich niezbędnych składników odżywczych i energii do rozwoju i (lub) regeneracji tkanek oraz utrzymania wszystkich czynności życiowych.
W tym przypadku aminokwasy są szczególnie ważne, gdyż niektóre z nich stanowią niezbędne składniki syntezy białek. Jednoczesne podawanie źródeł energii (węglowodanów/tłuszczów) jest konieczne, aby zachować aminokwasy do regeneracji tkanki i anabolizmu oraz zapobiec ich wykorzystaniu jako źródeł energii.
Glukoza jest metabolizowana przez wszystkie komórki organizmu. Niektóre tkanki i narządy, takie jak OUN, szpik kostny, erytrocyty, nabłonek cewek nerkowych pokrywają swoje zapotrzebowanie na
energię wyłącznie z metabolizmu glukozy. Dodatkowo glukoza pełni rolę składnika budulcowego różnych substancji wytwarzanych przez komórki.
Ze względu na swoją dużą gęstość energetyczną tłuszcze stanowią skuteczną formę podaży energii. Triglicerydy o dużej długości łańcucha dostarczają organizmowi niezbędnych kwasów tłuszczowych do syntezy składników komórkowych. Dlatego też emulsja tłuszczowa zawiera triglicerydy o średniej i dużej długości łańcucha (uzyskane z oleju sojowego i rybiego).
Frakcja triglicerydów o dużej długości łańcucha zawiera triglicerydy omega-3 i omega-6 dostarczające organizmowi wielonienasyconych kwasów tłuszczowych. Ich podstawowym zadaniem jest zapobieganie i leczenie niedoboru niezbędnych kwasów tłuszczowych. Stanowią one również źródło
energii. Omegaflex special bez elektrolitów zawiera niezbędne kwasy tłuszczowe omega-6, przede wszystkim w postaci kwasu linolowego i kwasy tłuszczowe omega-3 w postaci kwasu alfa- linolowego, kwasu eikozapentaenowego oraz kwasu dokozaheksaenowego. Stosunek zawartości kwasów omega-6 do kwasów omega-3 w Omegaflex special bez elektrolitów wynosi około 2,5:1.
Triglicerydy o średniej długości łańcucha ulegają znacznie szybszej hydrolizie, eliminacji z krążenia i całkowitemu utlenieniu niż triglicerydy o dużej długości łańcucha. Stanowią one preferowany substrat energetyczny, zwłaszcza przy zaburzeniach rozkładu i (lub) wykorzystania triglicerydów o dużej długości łańcucha, np. w przypadku niedoboru lipazy lipoproteinowej i (lub) niedoboru kofaktorów lipazy lipoproteinowej.
Wchłanianie
Produkt Omegaflex special bez elektrolitów jest podawany w infuzji dożylnej. W związku z tym wszystkie substraty są natychmiast dostępne dla metabolizmu.
Dystrybucja
Dawka, szybkość infuzji, stan metaboliczny i indywidualne czynniki pacjenta (poziom niedożywienia) mają decydujące znaczenie dla maksymalnie osiągalnego stężenia triglicerydów. Kiedy produkt jest używany zgodnie z instrukcją z zachowaniem zaleceń dotyczących dawek, stężenia triglicerydów w zasadzie nie przekraczają 4,6 mmol/l (400 mg/dl).
Kwasy tłuszczowe o średniej długości łańcucha wykazują niskie powinowactwo do albuminy. W doświadczeniach na zwierzętach z podawaniem emulsji zawierającej wyłącznie triglicerydy o średniej długości łańcucha wykazano, że kwasy tłuszczowe o średniej długości łańcucha mogą przenikać przez barierę krew-mózg w razie ich przedawkowania. Nie obserwowano żadnych działań niepożądanych przy stosowaniu emulsji dostarczających mieszaninę triglicerydów o średniej i dużej długości
łańcucha, ponieważ triglicerydy o dużej długości łańcucha hamują hydrolizę triglicerydów o średniej długości łańcucha. Dlatego też można wykluczyć toksyczne działanie na mózg po podaniu produktu leczniczego Omegaflex special bez elektrolitów.
Aminokwasy wbudowywane są w wiele białek tworzących różne narządy. Ponadto każdy aminokwas występuje w postaci wolnej we krwi i wewnątrz komórek.
Z uwagi na rozpuszczalność glukozy w wodzie, rozprowadzana jest ona przez krew po całym organizmie. Początkowo roztwór glukozy rozprowadzany jest do przestrzeni śródnaczyniowej, a następnie do przestrzeni wewnątrzkomórkowej.
Brak danych dotyczących przechodzenia składników przez barierę łożyskową. Metabolizm
Aminokwasy, które nie biorą udziału w syntezie białek, są metabolizowane w następujący sposób:
Grupa aminowa jest oddzielana od szkieletu węglowego w wyniku transaminacji. Łańcuch węglowy ulega bezpośredniemu utlenieniu do CO2 lub jest wykorzystywany jako substrat w procesie glukoneogenezy w wątrobie. Grupa aminowa jest również metabolizowana w wątrobie do mocznika.
Glukoza jest metabolizowana do CO2 i H2O przez znane ścieżki metaboliczne. Część glukozy jest wykorzystywana do syntezy tłuszczów.
Po infuzji triglicerydy są hydrolizowane do glicerolu i kwasów tłuszczowych. Związki te są włączane do szlaków metabolicznych prowadzących do wytworzenia energii, syntezy biologicznie czynnych
cząsteczek, glukoneogenezy i resyntezy tłuszczów.
Dokładniej, wielonienasycone kwasy tłuszczowe omega-3 o dużej długości łańcucha zastępują kwas arachidonowy jako substrat eikozanowy w błonach komórkowych i powodują zmniejszenie
wytwarzania w organizmie związków eikozanowych o charakterze zapalnym oraz cytokin. Może być
to korzystne dla pacjentów, u których występuje ryzyko rozwinięcia się nadmiernie nasilonego stanu zapalnego i posocznicy.
Eliminacja
Jedynie niewielka ilość aminokwasów wydalana jest z moczem w stanie niezmienionym.
Nadmiar glukozy wydalany jest z moczem wyłącznie wówczas, gdy osiągnięty zostanie próg nerkowy dla glukozy.
Zarówno triglicerydy oleju sojowego, jak i triglicerydy o średniej długości łańcucha są całkowicie metabolizowane do CO2 i H2O. Niewielkie ilości tłuszczów są tracone wyłączone wraz ze
złuszczającymi się komórkami skóry i innych nabłonków. Wydalanie triglicerydów przez nerki praktycznie nie zachodzi.
Nie prowadzono badań nieklinicznych preparatu Omegaflex special bez elektrolitów.
Nie należy oczekiwać toksycznego wpływu mieszanin składników odżywczych podawanych w zalecanych dawkach w ramach terapii substytucyjnej.
Toksyczny wpływ na reprodukcję
Różne oleje roślinne, zwłaszcza olej sojowy, mogą zawierać fitoestrogeny, takie jak ß-sitosterol. U szczurów i królików ß-sitosterol podawany podskórnie i dopochwowo powodował zaburzenia płodności. Po podaniu czystego ß-sitosterolu zgłaszano zmniejszenie masy jąder i zmniejszenie
stężenia plemników w nasieniu u samców szczura oraz zmniejszony odsetek ciąż u królic. Jednakże zgodnie z obecnym stanem wiedzy działania obserwowane u zwierząt wydają się nie mieć znaczenia w praktyce klinicznej.
Kwas cytrynowy jednowodny (do ustalania pH) Glicerol
Fosfolipidy jaja kurzego do wstrzykiwań Sodu oleinian
Sodu wodorotlenek (do ustalania pH) all-rac--tokoferol
Woda do wstrzykiwań
Produktu leczniczego nie wolno mieszać z innymi produktami leczniczymi, dla których nie wykazano zgodności. Patrz punkt 6.6.
Produkt leczniczy Omegaflex special bez elektrolitów nie powinien być podawany jednocześnie z krwią, patrz punkt 4.4.
Zamknięty
2 lata
Po otwarciu worka zewnętrznego i zmieszaniu zawartości worka
Wykazano stabilność chemiczną i fizykochemiczną przed użyciem mieszaniny aminokwasów, glukozy i tłuszczu przez okres 7 dni w temperaturze 2-8°C i przez dodatkowe 2 dni w temperaturze 25°C.
Po wprowadzeniu zgodnych substancji dodatkowych
Z mikrobiologicznego punktu widzenia produkt należy zużyć natychmiast po wprowadzeniu dodatkowych substancji. Jeśli produkt nie zostanie zużyty natychmiast po wprowadzeniu dodatkowych substancji, odpowiedzialność za okres przechowywania i warunki przechowywania przed użyciem ponosi użytkownik.
Po pierwszym otwarciu (przebicie portu do infuzji)
Emulsję należy zużyć natychmiast po otwarciu opakowania.
Nie przechowywać w temperaturze powyżej 25°C.
Nie zamrażać. W razie przypadkowego zamrożenia, worek należy wyrzucić.
Przechowywać worek w ochronnym worku zewnętrznym w celu ochrony przed światłem.
Trzykomorowy worek z wielowarstwowej folii (warstwa wewnętrzna z PP), umieszczony w zewnętrznym ochronnym worku, z saszetką zawierającą substancję pochłaniającą tlen oraz
wskaźnikiem tlenu, umieszczonymi w przestrzeni miedzy workiem bezpośrednim i zewnętrznym. Trzykomorowy worek wyposażony jest w system portów z PP i SEBS z zamknięciem z gumy poliizoprenowej. Trzykomorowe worki zawierają:
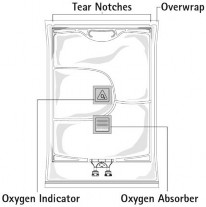
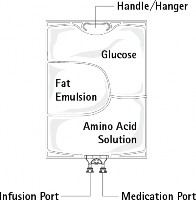
Punkty nacięć Opakowanie ochronne | Uchwyt/Wieszak Glukoza Emulsja tłuszczowa Roztwór aminokwasów Port infuzyjny Port podania leku | ||
Wskaźnik obecności tlenu | Pochłaniacz tlenu | ||
Rycina A Rycina B
Rysunek A: Wielokomorowy worek jest zapakowany w zewnętrzny worek ochronny. Pomiędzy workiem wewnętrznym i zewnętrznym znajduje się pochłaniacz tlenu i wskaźnik tlenu. Saszetka z pochłaniaczem tlenu jest wykonana z materiału obojętnego i zawiera wodorotlenek żelaza.
Rysunek B: Komora górna zawiera roztwór glukozy, komora środkowa — emulsję tłuszczową, a komora dolna — roztwór aminokwasów.
Komorę górną i komorę środkową można połączyć z komorą dolną, otwierając szwy pośrednie (zgrzewy).
Worek został tak zaprojektowany, aby umożliwić wymieszanie aminokwasów, glukozy, tłuszczów i elektrolitów w jednej komorze. Rozerwanie zgrzewu powoduje sterylne zmieszanie zawartości do postaci emulsji.
Rożne wielkości opakowań są dostarczane w tekturowych pudełkach zawierających pięć worków. Wielkości opakowań: 5 x 625 ml, 5 x 1250 ml i 5 x 1875 ml.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Brak specjalnych wymagań dotyczących usuwania.
Przed użyciem produkty do żywienia pozajelitowego należy skontrolować wzrokowo w celu wykrycia ewentualnych uszkodzeń, zmian barwy i niestabilności emulsji.
Nie należy używać worków, które są uszkodzone. Worek zewnętrzny i wewnętrzny, jak również zgrzewy pomiędzy komorami powinny być w stanie nienaruszonym. Produkt należy stosować wyłącznie, jeśli roztwory aminokwasów i glukozy są przezroczyste i bezbarwne do słomkowych, a
emulsja tłuszczowa jest jednorodna w kolorze mlecznobiałym. Nie używać, jeśli roztwory zawierają stałe cząstki.
Po zmieszaniu zawartości trzech komór nie używać, jeśli emulsja wykazuje odbarwienie lub oznaki rozdzielania faz (krople oleju, warstwa oleju). W razie odbarwienia emulsji lub oznak rozdzielania faz należy natychmiast przerwać infuzję.
Przed otwarciem worka zewnętrznego należy sprawdzić kolor wskaźnika tlenu (patrz Rysunek A). Nie używać, jeśli wskaźnik tlenu zmienił kolor na różowy. Używać wyłącznie, jeśli wskaźnik tlenu jest żółty.
Przygotowanie mieszanej emulsji
Należy ściśle przestrzegać zasad postępowania aseptycznego.
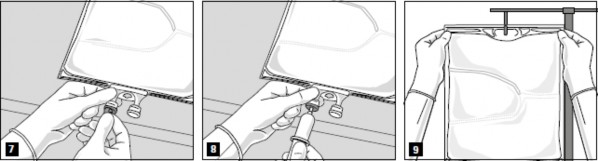
Otwieranie: Rozerwać worek zewnętrzny, zaczynając od nacięć (Rys. 1). Wyjąć worek wewnętrzny z opakowania ochronnego. Wyrzucić opakowanie zewnętrzne, wskaźnik tlenu i pochłaniacz tlenu.
Skontrolować wzrokowo worek wewnętrzny w celu wykrycia ewentualnych nieszczelności. Przeciekający worek należy wyrzucić, ponieważ nie można zagwarantować jałowości.
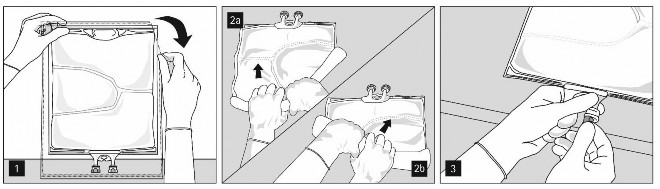
Aby kolejno otwierać komory i mieszać ich zawartość, należy zwinąć worek obiema rękami, zaczynając od otwarcia zgrzewu oddzielającego komorę górną (glukoza) i dolną (aminokwasy)
(Rys. 2a). Następnie w dalszym ciągu naciskać, aby otworzył się zgrzew oddzielający komorę środkową (tłuszcze) i komorę dolną (Rys. 2b).
Dodawanie innych dodatków
Po zdjęciu aluminiowej plomby (Rys. 3) można dodać zgodne dodatki przez port do dodawania leków (Rys. 4).
Omegaflex special bez elektrolitów można mieszać z następującymi dodatkami do określonych poniżej górnych granic stężenia lub maksymalnej ilości dodatków po suplementacji. Powstałe
mieszaniny są stabilne przez okres 7 dni w temperaturze od +2°C do +8°C plus 2 dni w temperaturze 25°C.
Szczegółowe informacje na temat wyżej wymienionych dodatków i odpowiednich terminów ważności takich mieszanin można uzyskać na żądanie od producenta.
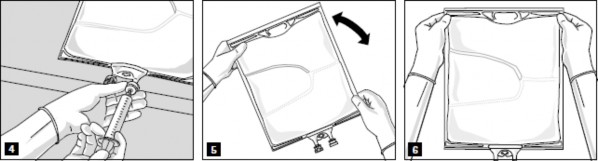
Wymieszać dokładnie zawartość worka (Rys. 5) i skontrolować wzrokowo mieszaninę (Rys. 6). Nie powinny występować oznaki rozdzielania faz emulsji.
Mieszanina to mlecznobiała jednorodna emulsja typu olej w wodzie.
Przygotowanie do infuzji
Przed infuzją emulsję należy podgrzać do temperatury pokojowej.
Zdjąć aluminiową plombę z portu infuzyjnego (Rys. 7) i podłączyć zestaw do infuzji (Rys. 8). Należy używać zestawu do podawania infuzji bez otworu odpowietrzającego albo zasłonić otwór odpowietrzający w razie stosowania zestawu z otworem. Zawiesić worek na stojaku do infuzji (Rys. 9) i prowadzić infuzję standardową techniką.
Wyłącznie do jednorazowego użycia. Po użyciu należy wyrzucić opakowanie i niezużyte resztki produktu.
Nie należy ponownie podłączać częściowo zużytych pojemników.
W razie konieczności zastosowania filtrów, muszą to być filtry przepuszczalne dla tłuszczów (wielkość porów ≥ 1,2 µm).
B. Braun Melsungen AG Carl-Braun-Straße 1 34212 Melsungen Niemcy
Adres do korespondencji:
B. Braun Melsungen AG 34209 Melsungen Niemcy
Tel.: +49-5661-71-0
Faks: +49-5661-71-4567
Pozwolenie nr 23781
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 2017-02-28
02.2021











